题目内容
8.课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其它杂质不计)和石灰浆为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰浆混合,发生的反应为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
(3)取适量粗产品溶于水,滴加Ba(NO3)2溶液出现白色浑浊,此反应的方程式为Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3,
该粗产品中一定没有Ca(OH)2,理由是由上可知一定有碳酸钠存在,而碳酸钠与氢氧化钙在溶液中不能共存.
(4)最终该小组同学确定该粗产品中含有三种物质.
分析 (1)根据氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析;
(3)根据硝酸钡和碳酸钠反应生成碳酸钡沉淀和硝酸钠,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠进行分析.
解答 解:(1)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)硝酸钡和碳酸钠反应生成碳酸钡沉淀和硝酸钠,化学方程式为:Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以该粗产品中一定没有Ca(OH)2,理由是:由上可知一定有碳酸钠存在,而碳酸钠与氢氧化钙在溶液中不能共存.
故答案为:(1)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)Ba(NO3)2+Na2CO3═BaCO3↓+2NaNO3,Ca(OH)2,由上可知一定有碳酸钠存在,而碳酸钠与氢氧化钙在溶液中不能共存.
点评 本题主要考查了盐的化学性质和化学方程式的书写,难度不大,需要在平时的学习中加强记忆即可完成.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
18.硒是抗衰老元素,且能抑制癌细胞生长.“北大富硒康”中含有硒酸根离子(SeO42-)则在硒酸根离子中硒元素的化合价为( )
| A. | -2价 | B. | -4价 | C. | +4价 | D. | +6价 |
19.如图表示的是化学基本反应类型的微观模型,(反应条件不出现)下列反应中与图中的反应类型一致的是( )


| A. | 2KClO3=2KCl+3O2↑ | B. | 2HI+Cl2=2HCl+I2 | ||
| C. | CO2+C=2CO | D. | HCl+NaOH=NaCl+H2O |
3.下列叙述中正确的是( )
| A. | 某物质不是单质就是化合物 | |
| B. | 某物质中只含有一种元素,该物质一定是纯净物 | |
| C. | 金刚石、石墨都是由碳元素组成的,但它们是两种不同的物质 | |
| D. | 同种分子构成的物质一定是单质 |
20.下面是关于物质分割的描述,其中分割到分子的是( )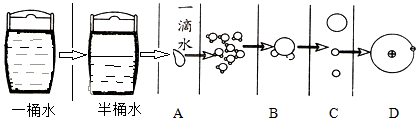

| A. | A | B. | B | C. | C | D. | D |
16. a、b、c三种物质的溶解度曲线如图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
a、b、c三种物质的溶解度曲线如图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
 a、b、c三种物质的溶解度曲线如图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )
a、b、c三种物质的溶解度曲线如图所示.现有t1℃时的a、b、c三种物质的饱和溶液,将其都升温至t2℃时,下列说法错误的是( )| A. | a溶液中的溶质质量分数最大 | B. | c溶液中的溶质质量分数最小 | ||
| C. | b溶液为不饱和溶液 | D. | c溶液中有晶体析出 |
