题目内容
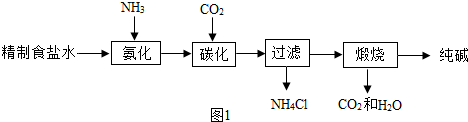
3.候德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献.他发明的候氏制碱法大大提高了原料的利用率.其工业流程大致如下:
下列有关该流程的说法中错误的是( )
| A. | 该流程的原料有空气、焦炭、水、氯化钠等物质 | |
| B. | 该流程除了制得产品纯碱之外,还能制得氮肥氯化铵 | |
| C. | 该流程中使用氯化钠的饱和溶液,有利于碳酸氢钠固体的析出 | |
| D. | 该流程中“其它”指示可循环利用的物质有二氧化碳、水两种物质 |
分析 A、根据侯氏制碱法的工业流程图,分析所需的原料即可.
B、根据侯氏制碱法的工业流程图进行分析判断.
C、根据氯化钠饱和溶液的作用进行分析判断.
D、根据侯氏制碱法的工业流程图进行分析判断.
解答 解:A、由侯氏制碱法的工业流程图,用到的原料有空气、焦炭、水、二氧化碳、氯化钠等,故选项说法正确.
B、该流程除了制得产品纯碱之外,剩余溶液中含有大量的氯化铵,可做氮肥,故选项说法正确.
C、该流程中使用氯化钠的饱和溶液,钠离子浓度高,有利于碳酸氢钠固体的析出,故选项说法正确.
D、该流程中“其它”指示可循环利用的物质是二氧化碳,故选项说法错误.
故选:D.
点评 本题难度不大,掌握“侯氏制碱法”的制取原理以及工业流程图等是正确解答本题的关键.

练习册系列答案
相关题目
14.下列各组固体物质,只用水不能进行鉴别的是( )
| A. | CaCO3、Na2CO3 | B. | MnO2 CuO | C. | 生石灰、熟石灰 | D. | CuSO4、Fe2(SO4)3 |
12.海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧.下图是某厂 生产纯碱的工艺流程图,有关说法错误的是( )

| A. | 流程Ⅰ加入过量的NaOH溶液是为了将粗盐水中的Mg2+转化为沉淀 | |
| B. | 按流程Ⅰ所加溶液的顺序除杂,过滤后得3种沉淀 | |
| C. | 流程Ⅱ加入氨气在制碱过程中可以增强二氧化碳的吸收量 | |
| D. | 流程Ⅲ发生的是分解反应 |
13. 根据表中信息,请回答下列问题:
根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“徽”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇到水就分解了.
(1)CaCO3属于不溶物(填“可溶物”、”徽溶物”或“不溶物”).
(2)表中可溶于水的硫酸盐有3种.
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应.若能,写出化学方程式;若不能,说明理由.2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲.
①溶液甲中溶质的组成情况可能有3种.
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
b.探究溶液甲中是否含Ba(OH)2
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由:3,溶液中含有BaCl2,不论是否含有Ba(OH)2均会产生白色沉淀.
③欲从溶液甲中获得纯净的BaCl2固体,应采取的简单操作是测溶液甲的pH,若pH≤7,蒸发结晶;若pH>7,向溶液甲中加入盐酸至溶液pH≤7,再蒸发结晶.
 根据表中信息,请回答下列问题:
根据表中信息,请回答下列问题:部分碱、酸、盐的溶解性表(20℃)
| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- | PO43- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | 溶 | |
| K+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | 不 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | - | 不 |
(1)CaCO3属于不溶物(填“可溶物”、”徽溶物”或“不溶物”).
(2)表中可溶于水的硫酸盐有3种.
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应.若能,写出化学方程式;若不能,说明理由.2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲.
①溶液甲中溶质的组成情况可能有3种.
②实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
| 方案编号 | 实验操作 | 实验现象 |
| 1 | 取少量溶液甲于试管中,加入铁粉 | 是否有气泡产生 |
| 方案编号 | 实验操作 | 实验现象 |
| 2 | 取少量溶液甲于试管中,加入Cu(NO3)2溶液 | 是否产生蓝色沉淀 |
| 3 | 取少量溶液甲于试管中,加入Na2SO4溶液 | 是否产生白色沉淀 |
③欲从溶液甲中获得纯净的BaCl2固体,应采取的简单操作是测溶液甲的pH,若pH≤7,蒸发结晶;若pH>7,向溶液甲中加入盐酸至溶液pH≤7,再蒸发结晶.