题目内容
9.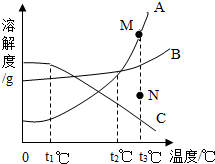 如图是A、B、C三种物质的溶解度曲线.下列叙述错误的是( )
如图是A、B、C三种物质的溶解度曲线.下列叙述错误的是( )| A. | 三种物质的溶解度大小顺序为A>B>C | |
| B. | t2℃时,A、B两种物质的饱和溶液溶质质量分数相等 | |
| C. | t3℃时B的饱和溶液降温到t1℃时仍为饱和溶液 | |
| D. | 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法 |
分析 解:A、由物质的溶解度随温度变化情况可以比较同一温度下不同物质的溶解度大小;
B、饱和溶液中溶质质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,由此可知:溶解度相等则溶质的质量分数相等;
C、B的溶解度随温度降低而减小,据此分析解答;
D、根据溶解度曲线下方的点为不饱和溶液,溶解度曲线上的点是饱和状态,并结合部饱和溶液和饱和溶液的转化方法分析解答.
解答 解:A、由于固体物质的溶解度会随温度的变化而变化,从图中可以看出,只有在高于t2℃时,三种物质的溶解度大小顺序才是A>B>C,故错误;
B、由于t2℃时,A、B两种物质的溶解度相等,所以A、B两种物质饱和溶液的溶质的质量分数一定相等.正确;
C、t3℃时B的饱和溶液降温到t1℃,溶解度变小,析出晶体,溶液仍然是饱和溶液,正确;
D、将组成在N点的A溶液转变为M点的A溶液,由不饱和状态变为饱和状态,由图示可知物质的温度没变,所以可采取恒温蒸发溶剂,或加入溶质的方法,正确;
故选:A.
点评 解答本题关键是要知道一定温度下物质溶解度的大小比较方法,知道饱和溶液的容质质量分数计算方法与该物质的溶解度有关,饱和溶液与不饱和溶液的相互转化.

练习册系列答案
相关题目
20. 钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )
钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )
 钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )
钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )| A. | 该元素是金属元素 | B. | 该元素的原子序数为94 | ||
| C. | 该元素的相对原子质量是244g | D. | 该元素的中子数为150 |
17.下列化学方程式书写正确的是( )
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
1.到高中我们将从元素原子得失电子的角度来认识氧化还原反应,而元素原子得失电子表现为元素化合价的变化.因此可以把元素化合价有升降的化学反应确定为氧化还原反应,据此可判断下列化学反应不属于氧化还原反应的是( )
| A. | Zn+CuSO4=ZnSO4+Cu | B. | CuO+CO$\frac{\underline{\;高温\;}}{\;}$ Cu+CO2 | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ |
19.已知M2+xR=W2+yQ是置换反应,M2和W2为单质,x、y为整数.下列关于该反应的说法正确的是( )
| A. | 该反应可能是铁与稀盐酸反应 | |
| B. | 反应物M2和R的质量比一定等于生成物W2和Q的质量比 | |
| C. | 若取10 g M2和10 g R反应,生成W2和Q的质量总和等于20 g | |
| D. | M2、R和 W2的相对分子质量分别是a、b、c,Q的相对分子质量可能是$\frac{a+2b-c}{2}$ |

 蒸发是初中阶段必须掌握的基本实验技能.
蒸发是初中阶段必须掌握的基本实验技能.