题目内容
6.下列图象有关量的变化趋势不能正确反映其对应操作的是( )| A. | 在一定量的CaCl2溶液中通入CO2气体 | |
| B. | 向NaOH溶液中逐滴加入稀盐酸 | |
| C. | 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | |
| D. | 等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应 |
分析 A、根据CaCl2溶液不与CO2气体反应分析;
B、根据向NaOH溶液中逐滴加入稀盐酸时溶液pH的变化分析;
C、根据金属与酸的反应分析;
D、根据CaCO3与稀盐酸的反应分析.
解答 解:A、CaCl2溶液与CO2气体不能反应生成沉淀,故A错误;
B、向NaOH溶液中逐滴加入稀盐酸,溶液pH的逐渐变小,故B正确;
C、等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应,镁反应的速率快,生成的氢气多,故C正确;
D、等质量CaCO3分别与等体积等质量分数的稀盐酸(足量)反应,粉末状反应的快,但生成的二氧化碳气体一样多,故D正确.
故选A.
点评 本题是化学反应中定量关系和图象相结合的题型,题目难度较大.要准确解答此类题,关键要对化学反应知识熟练,并能结合图象的数学意义,综合考虑,可快速解答.图象的意义要抓住三点:①抓图象的起点,②抓图象的终点,③抓图象的变化过程.具体可结合解答领会.

练习册系列答案
相关题目
16.CuO和Cu(OH)2固体混合粉末20g,其中铜元素的质量分数为72%,放入一定量的稀硫酸中,恰好与两种固体完全反应,反应后形成溶液的溶质质量分数为18%,则加入稀硫酸的溶质质量分数为( )
| A. | 21.6% | B. | 12.25% | C. | 22.5% | D. | 10.8% |
14.室验室开放日,我与小娜、小佳、小华、小丽等同学来到实验室,看到实验桌上摆放着几瓶无标签的试剂,有固体和也有液体,我们决定对“固体与液体”之间的反应进行一些探究.
(1)小娜同学从一瓶固体和一瓶液体中各取少量试剂于试管中进行混合,立即产生了一种无色气体,我们对此气体展开了一系列探究:(1)①此气体是什么物质?验证它的实验方案如下:
产生此气体的化学方程式可能是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②我想制取该气体,采用的发生装置可选取下图中的B(填序号),收集装置是C或E.

③F也是收集该气体的装置,收集时气体应该由a端(填“a”或“b”)导入.
(2)我猜想此无色气体还可能是别的两种气体,它们是H2、CO2(填化学式).
小丽同学从另外两瓶中分别取少量固体和液体于试管中,发现混合后,固体也发生了变化,但无气泡放出.同学们对加入试管中的固体和液体从不同的反应类型、物质类别等方面进行了大胆的猜想,请仿照小娜同学把你的猜想补充在她的后面,与大家分享.每答对一个猜想将奖励1分,计4分,但化学试卷总分不超过60分.
(1)小娜同学从一瓶固体和一瓶液体中各取少量试剂于试管中进行混合,立即产生了一种无色气体,我们对此气体展开了一系列探究:(1)①此气体是什么物质?验证它的实验方案如下:
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是氧气 |
②我想制取该气体,采用的发生装置可选取下图中的B(填序号),收集装置是C或E.

③F也是收集该气体的装置,收集时气体应该由a端(填“a”或“b”)导入.
(2)我猜想此无色气体还可能是别的两种气体,它们是H2、CO2(填化学式).
小丽同学从另外两瓶中分别取少量固体和液体于试管中,发现混合后,固体也发生了变化,但无气泡放出.同学们对加入试管中的固体和液体从不同的反应类型、物质类别等方面进行了大胆的猜想,请仿照小娜同学把你的猜想补充在她的后面,与大家分享.每答对一个猜想将奖励1分,计4分,但化学试卷总分不超过60分.
| 小娜的猜想 | 金属与盐溶液发生的置换反应; |
| 我的猜想1 | |
| 我的猜想2 | |
| 我的猜想3 | |
| 我的猜想4 | |
| … |
1.某化合物是由氢、氧及另一种元素组成,下列对该化合物判断正确的是( )
| A. | 可能是氧化物 | B. | 可能是盐 | C. | 一定是碱 | D. | 不可能是酸 |
11.在一次化学实验中,同学们将饱和CuSO4溶液逐滴加到5ml饱和NaOH溶液中,观察到以下异常实验现象:
(1)在实验①中同学们根据所学初中化学知识判断蓝色沉淀是Cu(OH)2,请你写出生成蓝色沉淀的化学方程式CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(2)已知:Ⅰ.Cu(OH)2在室温下稳定,70℃~80℃时可脱水分解生成CuO;Ⅱ.酮酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色:
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究:小陶认为蓝色沉淀消失可能是Cu(OH)2发生了分解,其他同学一致否定了他的猜测,理由是沉淀消失,形成亮蓝色溶液,而氢氧化铜分解产生的是黑色固体(合理即可);
(3)同学们交流讨论后,提出以下两种猜想:猜想一:少许Cu(OH)2可溶于足量水中;猜想二:Cu(OH)2粉末(其它试剂可任选)设计如下实验,请你填写表中的空格:
(4)根据实验,并进一步查阅资料知道,Cu(OH)2在浓NaOH溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是Cu(OH)2+2NaOH=Na2Cu(OH)4;根据实验可知饱和CuSO4溶液与饱和NaOH溶液的反应是放热反应,依据的实验现象是资料Ⅰ显示Cu(OH)2在室温下稳定,70℃-80℃时可脱水分解生成CuO,而表格1可知随着氢氧化钠溶液的滴加,观察到产生蓝色沉淀,且沉淀逐渐增多.振荡后沉淀不消失,很快沉淀逐渐变黑色(合理即可).
| 实验序号 | 滴加CuSO4 | 实验现象 |
| ① | 第1-6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7-9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
(2)已知:Ⅰ.Cu(OH)2在室温下稳定,70℃~80℃时可脱水分解生成CuO;Ⅱ.酮酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色:
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究:小陶认为蓝色沉淀消失可能是Cu(OH)2发生了分解,其他同学一致否定了他的猜测,理由是沉淀消失,形成亮蓝色溶液,而氢氧化铜分解产生的是黑色固体(合理即可);
(3)同学们交流讨论后,提出以下两种猜想:猜想一:少许Cu(OH)2可溶于足量水中;猜想二:Cu(OH)2粉末(其它试剂可任选)设计如下实验,请你填写表中的空格:
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5ml蒸馏水中,充分振荡 | 沉淀不消失 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加到NaOH浓溶液中,充分振荡 | 沉淀消失,溶液变成亮蓝色 | 猜想二正确 |
18.如图是某元素的原子结构示意图和该元素在元素周期表中的单元格,下列说法不正确的是( )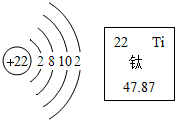

| A. | 该原子的最外层电子能量比最内层电子能量大 | |
| B. | 该原子在化学变化中容易失去电子 | |
| C. | 该元素属于金属元素 | |
| D. | 该原子的质量由其原子的质子和电子决定 |
