题目内容
9.实验室常用的干燥剂“碱石灰”是氧化钙和固体氢氧化钠的混合物,易与空气中的水蒸气和二氧化碳反应而变质.某同学对一瓶久置的碱石灰进行了如下探究:【猜想与假设】
猜想一:没有变质,只含有氧化钙和氢氧化钠;
猜想二:部分变质;
猜想三:完全变质,含有碳酸钙和碳酸钠,则氢氧化钠变质的化学反应方程式是2NaOH+CO2═Na2CO3+H2O.
【进行实验】实验如图所示:

【解释与结论】由操作②的现象判断:猜想三不成立(填“成立”或“不成立”);由操作⑤⑥的现象判断滤液中含有Na2CO3,由此判断猜想一不成立.写出操作④的化学反应方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
【反思与评价】实验室中碱石灰应该密闭保存.
分析 【猜想与假设】根据变质的情况分析:氢氧化钠和二氧化碳反应产生碳酸钠,氧化钙和水反应产生氢氧化钙、氢氧化钙和二氧化碳反应产生碳酸钙;
【解释与结论】根据现象进行分析判断得出结论:氧化钙和水反应放热、氢氧化钠溶于水放热,碳酸钠、碳酸钙与盐酸反应产生气泡;
【反思与评价】根据结论分析.
解答 解:【猜想与假设】氢氧化钠和二氧化碳反应产生碳酸钠,氧化钙和水反应产生氢氧化钙、氢氧化钙和二氧化碳反应产生碳酸钙,因此可能是完全变质,成分是碳酸钠和碳酸钙;故填:碳酸钙、碳酸钠;2NaOH+CO2═Na2CO3+H2O;
【解释与结论】混合物加水后试管壁发热,但是Ca(OH)2、CaCO3和Na2CO3加入水中不会放出热量,因此一定含有氧化钙或氢氧化钠;浑浊液中的滤渣中滴加盐酸,产生气泡,说明混合物中有碳酸钙;滤液中滴加盐酸有气泡,加澄清石灰水有沉淀生成,说明滤液中有碳酸钠,因此是部分变质;则猜想三不成立;由操作⑤⑥的现象判断滤液中含有碳酸钠和碳酸钙;碱石灰样品加足量水后得到了浊液,说明有不溶于水的物质产生,根据生石灰和氢氧化钠的变质情况,由反应的化学方程式:CaO+H2O=Ca(OH)2,Ca(OH)2+CO2=CaCO3↓+H2O,2NaOH+CO2=Na2CO3+H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,可以推断此不溶于水的物质为碳酸钙,所以操作④是碳酸钙与盐酸的反应,故填:不成立;Na2CO3;CaCO3+2HCl=CaCl2+H2O+CO2↑;
【反思与评价】通过实验可知,碱石灰在空气中极易变质,因此应该密闭保存.故填:密闭.
点评 本题属于物质变质程度的探究,依据实验的现象得出结论,结合相关物质的性质分析即可,难度不大.

练习册系列答案
相关题目
17.对于下列化学用语,有关说法正确的是( )
①N2②Mg2+③ ④
④ ⑤
⑤
①N2②Mg2+③
 ④
④ ⑤
⑤
| A. | ①可表示两个氮原子 | B. | ③可表示一种化合物分子 | ||
| C. | ②和⑤均表示阳离子 | D. | ④和⑤表示的微粒化学性质相同 |
14.某种冷烫精的主要成分溴酸钠(NaBrO3),对皮肤有刺激作用,使用不当会引起皮炎.溴酸钠中溴(Br)元素的化合价为( )
| A. | -5 | B. | +3 | C. | +4 | D. | +5 |
18.下列物质的用途中,所利用的性质与另外三种有本质区别的是( )
| A. | 氧气用于医疗急救 | B. | 二氧化碳用于灭火 | ||
| C. | 稀有气体用于霓虹灯 | D. | 一氧化碳用于冶金工业 |
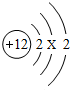 将宏观、微观及化学符号联系在一起是化学学科的特点.
将宏观、微观及化学符号联系在一起是化学学科的特点.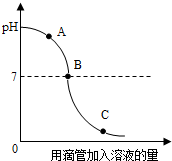 实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.根据如图回答下列问题:
实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.根据如图回答下列问题:
 已知A、B、C以及甲、乙均为初中化学常见的物质,其转化关系如图所示.
已知A、B、C以及甲、乙均为初中化学常见的物质,其转化关系如图所示.