题目内容
7.碳元素可组成多种单质和众多的化合物.(1)碳单质石墨是常用的电极材料,这是因为石墨具有导电性.
(2)工业上用一氧化碳在高温下还原铁矿石中的氧化铁(Fe2O3),发生反应的化学方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)有机化合物都含碳元素,其中最简单的有机化合物是CH4.
(4)利用温室气体CO2制取化工原料X的反应:2CO2+6H2→X+4H2O,X化学式为C2H4.
分析 根据已有的物质的性质进行分析解答,石墨具有导电性,一氧化碳能与氧化铁高温反应生成铁和二氧化碳;最简单的有机物是甲烷,根据质量守恒定律可以推断化学方程式中某物质的化学式.
解答 解:(1)石墨是常用的电极材料是因为石墨具有导电性,故填:导电性;
(2)一氧化碳能与氧化铁高温反应生成铁和二氧化碳,故填:3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)最简单的有机物是甲烷,故填:CH4;
(4)2CO2+6H2→X+4H2O,反应前含有2个C原子,4个O原子,12个H原子,反应后含有8个H原子,4个O原子,故X中含有2个C原子,4个H原子,故其化学式为:C2H4,故填:C2H4.
点评 本题考查的是常见的物质的性质以及质量守恒定律的应用,完成此题,可以依据已有的知识进行.

练习册系列答案
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
17. 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加稀盐酸,沉淀的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )| A. | 可能存在Na2SO4 | B. | 不存在NaOH | ||
| C. | 肯定存在BaCl2 | D. | 肯定只存在Na2CO3 |
18.下列生活事实的解释中,不合理的是( )
| A. | 漂白粉可杀菌消毒,因其具有吸附性 | |
| B. | 洗洁精可清除油污,因其具有乳化作用 | |
| C. | 某合金可做保险丝,因该合金的熔点低 | |
| D. | 氦气可填充气球,因其密度小和化学性质稳定 |
15.下列有关营养素的说法错误的是( )
| A. | 蛋白质是一切生命活动的基础 | |
| B. | 人摄入的碳水化合物过多,剩余部分可以转化为脂肪 | |
| C. | 大多数维生素不能在体内合成,需要从食物中摄取 | |
| D. | 纤维素在人体中能够转化为葡萄糖 |
2.下列图象能正确反映对应的实验操作的是( )
| A. |  向一定量的饱和石灰水中加入氧化钙 | |
| B. |  加热一定量高锰酸钾固体产生氧气 | |
| C. |  高温煅烧CaCO3 | |
| D. |  O2在水中的溶解性 |
19.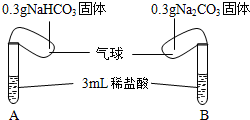 碳酸钠、碳酸氢钠是中学常见的化合物.
碳酸钠、碳酸氢钠是中学常见的化合物.
探究一:碳酸钠、碳酸氢钠与酸反应如图所示,将两气球内的NaHCO3和Na2CO3同时倒入试管中.已知盐酸足量,且装置气密性良好.
回答下列问题:
(1)碳酸钠俗名是纯碱.
(2)实验过程中观察到的现象是:固体溶解、气泡产生,气球胀大.
(3)NaHCO3和Na2CO3都能与盐酸反应产生二氧化碳、水和氯化钠.任写出其中一个反应的化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑或NaHCO3+HCl═NaCl+H2O+CO2↑.
(4)已知NaHCO3、Na2CO3的相对分子质量分别为84、106,通过计算:实验结束后,A(填“A”或“B”)试管的气球更大.
探究二:碳酸氢钠、碳酸钠固体与酸反应的热效应
【发现问题】在探究一实验过程中用手触摸试管,发现盛NaHCO3的试管温度降低,而盛Na2CO3的试管温度升高.
【猜想与推测】甲同学由此推测:NaHCO3和盐酸反应为吸热反应,Na2CO3和盐酸反应为放热反应.
【实验与数据】乙同学认为甲同学推测不妥,通过以下多次实验后取平均值数据记录如下:
【分析与结论】
(1)由步骤①~③比较得到的结论是Na2CO3溶于水放热,而NaHCO3溶于水吸热.
(2)由步骤④~⑤比较得到的结论是:Na2CO3溶液、NaHCO3溶液与稀盐酸反应都是放热.
(3)结合上面探究活动,你认为甲同学推测的不妥之处是判断固体与溶液物质反应的能量变化需综合考虑物质溶解过程的能量变化及反应过程的能量变化.
 碳酸钠、碳酸氢钠是中学常见的化合物.
碳酸钠、碳酸氢钠是中学常见的化合物.探究一:碳酸钠、碳酸氢钠与酸反应如图所示,将两气球内的NaHCO3和Na2CO3同时倒入试管中.已知盐酸足量,且装置气密性良好.
回答下列问题:
(1)碳酸钠俗名是纯碱.
(2)实验过程中观察到的现象是:固体溶解、气泡产生,气球胀大.
(3)NaHCO3和Na2CO3都能与盐酸反应产生二氧化碳、水和氯化钠.任写出其中一个反应的化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑或NaHCO3+HCl═NaCl+H2O+CO2↑.
(4)已知NaHCO3、Na2CO3的相对分子质量分别为84、106,通过计算:实验结束后,A(填“A”或“B”)试管的气球更大.
探究二:碳酸氢钠、碳酸钠固体与酸反应的热效应
【发现问题】在探究一实验过程中用手触摸试管,发现盛NaHCO3的试管温度降低,而盛Na2CO3的试管温度升高.
【猜想与推测】甲同学由此推测:NaHCO3和盐酸反应为吸热反应,Na2CO3和盐酸反应为放热反应.
【实验与数据】乙同学认为甲同学推测不妥,通过以下多次实验后取平均值数据记录如下:
| 步骤① | 步骤② | 步骤③ | 步骤④ | 步骤⑤ |
| 测量10mL水温/℃ | 加入物质0.5g | 溶解后测量溶液温度t1/℃ | 静置一段时间后测量溶液温度t2/℃ | 加入20%盐酸10mL反应后测量溶液温度t3/℃ |
| 20 | NaHCO3 | 18.5 | 20.0 | 20.8 |
| 20 | Na2CO3 | 23.3 | 20.0 | 23.7 |
(1)由步骤①~③比较得到的结论是Na2CO3溶于水放热,而NaHCO3溶于水吸热.
(2)由步骤④~⑤比较得到的结论是:Na2CO3溶液、NaHCO3溶液与稀盐酸反应都是放热.
(3)结合上面探究活动,你认为甲同学推测的不妥之处是判断固体与溶液物质反应的能量变化需综合考虑物质溶解过程的能量变化及反应过程的能量变化.
16.中国梦,小康梦.射阳濒临黄海,物产丰富,新农村建设如火如荼.射阳地方特色农副产品享誉全国、蜚声海外.下列射阳特产富含糖类的是( )
| A. | 射阳大米 | B. | 海河秋白梨 | C. | 射阳河银鱼 | D. | 千秋酱油 |