题目内容
19. 如图是一瓶铝盐溶液,请用正确的化学用语填空:
如图是一瓶铝盐溶液,请用正确的化学用语填空:(1)写出溶液中大量存在的阴离子的符号Cl-.
(2)在溶质的化学式上标出铝元素的化合价$\stackrel{+3}{Al}$Cl3.
(3)写出该铝盐与氢氧化钾反应的化学方程式3KOH+AlCl3=Al(OH)3↓+3KCl.
分析 (1)根据标签,氯化铝溶液中的阴离子是氯离子,进行分析解答.
(2)化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后.
(3)氯化铝与氢氧化钾反应生成氢氧化铝沉淀和氯化钾,写出反应的化学方程式即可.
解答 解:(1)氯化铝溶液中的阴离子是氯离子,其离子符号为:Cl-.
(2)氯化铝中铝元素显+3价,由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,氯化铝中铝元素显+3价可表示为:$\stackrel{+3}{Al}$Cl3.
(3)氯化铝与氢氧化钾反应生成氢氧化铝沉淀和氯化钾,反应的化学方程式为:3KOH+AlCl3=Al(OH)3↓+3KCl.
故答案为:(1)Cl-;(2)$\stackrel{+3}{Al}$Cl3;(3)3KOH+AlCl3=Al(OH)3↓+3KCl.
点评 本题难度不大,掌握常见化学用语(化学方程式、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
7.某研究小组对自动充气气球(示意图如图1)进行下列探究.
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
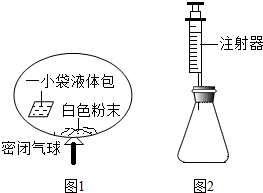
实验①的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;表中x=0.1;V1 >V2(填“>”、“<”或“=”)、
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:

| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
[分析并得出结论]
(5)白色粉末是碳酸氢钠、


 化学就在我们身边,与我们的生活有着密切的联系.
化学就在我们身边,与我们的生活有着密切的联系.