题目内容
20.炎热的夏天,小林打开冰箱,从4℃的储藏室里拿出一杯底部还有少量蔗糖晶体的溶液A,在室温下放置一段时间后,发现晶体消失了,得到溶液B,判断下列说法不正确的是( )| A. | 4℃时,A溶液一定是饱和溶液 | B. | 室温下,B溶液一定是饱和溶液 | ||
| C. | 温度越高蔗糖晶体的溶解能力越强 | D. | B溶液一定比A溶液的浓度大 |
分析 4℃拿出一杯底部有少量蔗糖的溶液A,因为蔗糖未全部溶解,所以A在4℃时,溶液A一定是饱和溶液,放置室温一段时间后晶体消失,说明未溶解的蔗糖再次溶于水,所以溶液A的质量分数小于溶液B的质量分数,蔗糖晶体的溶解度随着温度的升高而升高,室温下溶液B不一定是饱和溶液,可能饱和也可能不饱和.
解答 解:在在整个变化过程中A在4℃时,因存在不溶的晶体所以溶液A一定是饱和溶液,放置室温一段时间后晶体消失,说明未溶解的蔗糖再次溶于水,溶液是否饱和无法判断,但溶质质量分数会变大,由4℃变到20℃时物质的溶解度变大也就是随温度的升高而增大.
故选:B.
点评 此题是对溶液变化的状态的考核,解题的关键是能够对溶液的各步的变化有较深入的认识,分清溶液是否在变化后处于饱和状态,是一道能训练学生思维的综合题.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
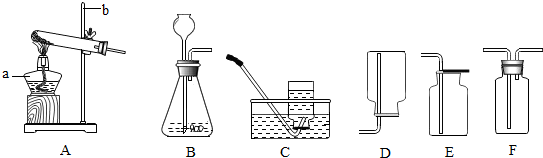
10.某课外小组的同学将玻璃罩内充满纯净的二氧化碳气体,如图A所示,在光照充足的条件下,经过一段时间后,该小组同学用注射器从a处抽取气体,测定玻璃罩内气体的成分及其含量.

【查阅资料】
①植物通过光合作用吸收二氧化碳气体,放出氧气.
②氢氧化钠和氢氧化钙性质相似,其水溶液都能与二氧化碳发生反应,且没有气体物质生成.
【实验一】检验玻璃罩内是否含有二氧化碳气体?
【实验二】采用两种方法测定玻璃罩内气体中氧气的含量.
方法1:用如图B所示的装置测量气体中氧气的含量.
(1)将抽取出的气体用排水法收集到150mL的集气瓶中,燃烧匙中点燃的固体药品的名称是红磷;其燃烧现象为产生大量的白烟;反应方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)待装置冷却到室温后,打开弹簧夹,烧杯中的液体进入集气瓶中,其原因是氧气在磷燃烧中被消耗,在大气压强的作用下烧杯中的液体进入集气瓶中;
(3)实验结束后,集气瓶中进入液体的体积约为125mL.
方法2:用如图C所示的装置测量气体中氧气的含量.
(1)抽取150mL的气体,缓缓地从b处通入装置中;
(2)实验结束后,c处气体的化学式为O2,集气瓶中排出液体的体积约为75mL.
【实验二讨论】通过对比,该小组同学发现,两种方法所得实验结果差距较大,其中实验结果更准确的是方法2(填写“方法1”或“方法2”),该方法所测得氧气约占气体总体积的50%.另一实验方法中不合理的实验操作是方法1,装置冷却后,进入的水中含有二氧化碳(友情提示:请注明是哪种方法).

【查阅资料】
①植物通过光合作用吸收二氧化碳气体,放出氧气.
②氢氧化钠和氢氧化钙性质相似,其水溶液都能与二氧化碳发生反应,且没有气体物质生成.
【实验一】检验玻璃罩内是否含有二氧化碳气体?
| 实验步骤 | 实验现象 | 实验结论 |
| 抽取适量气体,注入澄清石灰水中 | 有白色沉淀产生 | 玻璃罩内含有二氧化碳气体 |
方法1:用如图B所示的装置测量气体中氧气的含量.
(1)将抽取出的气体用排水法收集到150mL的集气瓶中,燃烧匙中点燃的固体药品的名称是红磷;其燃烧现象为产生大量的白烟;反应方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(2)待装置冷却到室温后,打开弹簧夹,烧杯中的液体进入集气瓶中,其原因是氧气在磷燃烧中被消耗,在大气压强的作用下烧杯中的液体进入集气瓶中;
(3)实验结束后,集气瓶中进入液体的体积约为125mL.
方法2:用如图C所示的装置测量气体中氧气的含量.
(1)抽取150mL的气体,缓缓地从b处通入装置中;
(2)实验结束后,c处气体的化学式为O2,集气瓶中排出液体的体积约为75mL.
【实验二讨论】通过对比,该小组同学发现,两种方法所得实验结果差距较大,其中实验结果更准确的是方法2(填写“方法1”或“方法2”),该方法所测得氧气约占气体总体积的50%.另一实验方法中不合理的实验操作是方法1,装置冷却后,进入的水中含有二氧化碳(友情提示:请注明是哪种方法).
11.我们接触过的有些化学反应是无明显现象的.如图三个实验都是通过滴加其他试剂的方法,使之产生明显的现象,以证明反应确实发生了.请回答下列问题.

(1)实验甲中能证明反应发生的现象是溶液由红色变为无色,该现象可说明反应后的溶液中一定
不含有的溶质是氢氧化钠.
(2)从研究原理得知,实验乙可通过滴加酸碱指示剂的方法证明反应发生了,实验乙中选用的酸碱指示剂是紫色石蕊试液.请写出实验乙中反应的化学方程式CO2+H2O=H2CO3.
(3)实验丙中,玲玲同学选用了两种不同类别的试剂都证明了氢氧化钠溶液和二氧化碳能发生反应.请
你帮她把实验报告补充完整.
实验结束后,同学们对反应后所得溶液的成分展开了讨论.方案一最终所得溶液中的溶质是氯化钠和氯化氢.

(1)实验甲中能证明反应发生的现象是溶液由红色变为无色,该现象可说明反应后的溶液中一定
不含有的溶质是氢氧化钠.
(2)从研究原理得知,实验乙可通过滴加酸碱指示剂的方法证明反应发生了,实验乙中选用的酸碱指示剂是紫色石蕊试液.请写出实验乙中反应的化学方程式CO2+H2O=H2CO3.
(3)实验丙中,玲玲同学选用了两种不同类别的试剂都证明了氢氧化钠溶液和二氧化碳能发生反应.请
你帮她把实验报告补充完整.
| 方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取通入二氧化碳后的溶液少量于试管中,滴加过量的稀盐酸 | 有气泡产生 | 氢氧化钠溶液和二 氧化碳能发生反应 |
| 方案二 | 取通入二氧化碳后的溶液少量于试管中,滴加少量的氢氧化钙溶液 | 产生白色沉淀 |
8.现有一包白色固体,可能足Na2CO3、Na2SO4、NaOH中的一种或几种.为探究该白色固体的组成,小科同学做了如下实验:
由此可以判断:该白色固体定含有Na2CO3.一定没有Na2SO4.步骤②中产生的白色沉淀是NaOH.
| 实验步骤 | 实验操作 | 实验现象 |
| ① | 取少量白色固体溶于蒸馏水 | 溶液呈无色 |
| ② | 取①所得溶液少量,加入BaCl2溶液 | 产生白色沉淀 |
| ③ | 在②所得白色沉淀中加入稀HNO3 | 白色沉淀全部溶解,并放出气体 |
 用红磷在集气瓶中燃烧来测定空气中氧气的含量,发生的实验现象是:
用红磷在集气瓶中燃烧来测定空气中氧气的含量,发生的实验现象是: 某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去 氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.
某同学为比较镁和铝的金属活动性强弱,将两块表面积相同并除去 氧化膜的镁条、铝条分别与相同体积、相同质量分数的稀硫酸反应,测定两种金属与稀硫酸反应得到相同体积氢气所需要的时间.