题目内容
8.如果要除去CO2中少量的CO,应该采用的方法是( )| A. | 把混合气体点燃 | |
| B. | 把混合气体通过灼热的氧化铜粉 | |
| C. | 把混合气体通过澄清石灰水 | |
| D. | 把混合气体由一个容器倾倒到另一个容器里 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项所采取的方法错误.
B、一氧化碳能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、二氧化碳能与澄清石灰水反应生成碳酸钙和水,一氧化碳不石灰水反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、把混合气体由一个容器倾倒到另一个容器里,并能除去杂质,故选项所采取的方法错误.
故选:B.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
20.下列曲线能正确表达对应的反应或过程的是( )
| A. |  NH4NO3固体溶于水 | |
| B. |  煅烧石灰石 | |
| C. |  等质量等浓度的稀H2SO4加入金属 | |
| D. |  CuSO4和H2SO4混合液中加入NaOH溶液 |
17.某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由红色变为无色.结论:两种物质发生了反应,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O.
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲同学的实验继续探究:
【提出问题】甲实同学实验后的溶液中的溶质是什么?
【提出猜想】猜想一:只有CaCl2;猜想二:有CaCl2和HCl;猜想三:有CaCl2和Ca(OH)2.
【实验探究】为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
【实验评价】丙同学的2个方案都有不足之处,其中
方案1的不足之处是:方案1中使用pH试纸的操作不对;
方案2的不足之处是:.
注意:若答对下列一小题奖励4分,但化学试卷总分不超过60分
【实验拓展】若证明猜想二正确,请你在设计一个简单的实验方案(包括步骤、现象、结论).
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由红色变为无色.结论:两种物质发生了反应,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O.
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲同学的实验继续探究:
【提出问题】甲实同学实验后的溶液中的溶质是什么?
【提出猜想】猜想一:只有CaCl2;猜想二:有CaCl2和HCl;猜想三:有CaCl2和Ca(OH)2.
【实验探究】为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 | 方案1 | 方案2 |
| 实验操作(分别取少量甲同学实验后的溶液置于试管中) |  |  |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
方案1的不足之处是:方案1中使用pH试纸的操作不对;
方案2的不足之处是:.
注意:若答对下列一小题奖励4分,但化学试卷总分不超过60分
【实验拓展】若证明猜想二正确,请你在设计一个简单的实验方案(包括步骤、现象、结论).
 工业上以大理石和赤铁矿为主要原料可以制取B和G,其转化关系如图所示,
工业上以大理石和赤铁矿为主要原料可以制取B和G,其转化关系如图所示,

 蒸汽挂烫机由于使用方便而走入我们的生活.
蒸汽挂烫机由于使用方便而走入我们的生活.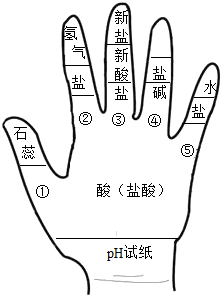 构建模型和构建知识网络是化学学习中重要的学习方法,小华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
构建模型和构建知识网络是化学学习中重要的学习方法,小华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题: 为测定某赤铁矿石的成量分数,某同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,该溶液总质量与反应时间的变化关系如图.(二氧化碳与氢氧化钠反应,CO2+2NaOH═Na2CO3+H2O)
为测定某赤铁矿石的成量分数,某同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,该溶液总质量与反应时间的变化关系如图.(二氧化碳与氢氧化钠反应,CO2+2NaOH═Na2CO3+H2O)