题目内容
18. 为测定某赤铁矿石的成量分数,某同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,该溶液总质量与反应时间的变化关系如图.(二氧化碳与氢氧化钠反应,CO2+2NaOH═Na2CO3+H2O)
为测定某赤铁矿石的成量分数,某同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,该溶液总质量与反应时间的变化关系如图.(二氧化碳与氢氧化钠反应,CO2+2NaOH═Na2CO3+H2O)(1)所用氢氧化钠溶液的溶质质量分数为12%.
(2)计算该赤铁矿石中氧化铁的质量分数(写出完整计算过程 ).
(3)若上述反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式:$\frac{10-m}{3}$×100%(用含m的代数式表示).
分析 (1)分析图象可得二氧化碳的质量,结合方程式即可解答;
(2)根据二氧化碳的已知量,设出未知量氧化铁,利用化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,列比例式,即可求出三氧化二铁的质量,即可解答;
(3)根据氧化铁中铁元素的质量分数,求出10g赤铁矿石样品铁的质量,此数值就等于反应后剩余固体质量m减去杂质的质量,建立关系式,即可求出用m表示的表达式.
解答 解:(1)由图象知,反应产生二氧化碳的质量为106.6-100.0=6.6g,
设,所用氢氧化钠溶液的溶质质量为a
CO2+2NaOH═Na2CO3+H2O
44 80
6.6g a
$\frac{44}{6.6g}=\frac{80}{a}$
a=12g
所用氢氧化钠溶液的溶质质量分数为:$\frac{12g}{100g}×100%$=12%
故填:12%;
(2)设赤铁矿石中氧化铁的质量为x,
3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 3×44
x 6.6g
$\frac{160}{x}=\frac{3×44}{6.6g}$
解得,x=8.0g
样品中氧化铁的质量分数为:$\frac{8.0g}{10g}$×100%=80%
答:该样品中氧化铁的质量分数为80%.
(3)方法1:设赤铁矿石中氧化铁质量分数为y,由于杂质不反应,也进入了最后的固体,所以m中包含了10g样品的杂质,所以用m减去杂质就是铁的质量.则:
10gy×$\frac{112}{160}$×100%=m-(1-y)×10g
解得,y=$\frac{10-m}{3}$×100%
答:该赤铁矿石中氧化铁质量分数的表达式为$\frac{10-m}{3}$×100%.
点评 分析图表中数据时,要关注造成数据发生变化的原因,分析数据不再改变时所说明的问题,从而发现隐含条件.

| A. | 把混合气体点燃 | |
| B. | 把混合气体通过灼热的氧化铜粉 | |
| C. | 把混合气体通过澄清石灰水 | |
| D. | 把混合气体由一个容器倾倒到另一个容器里 |
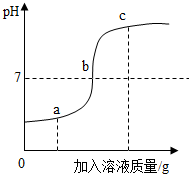 向20g溶质质量分数为3.65%的盐酸中逐滴加入NaOH溶液,得到的溶液pH变化图象如图所示.下列说法不正确的是( )
向20g溶质质量分数为3.65%的盐酸中逐滴加入NaOH溶液,得到的溶液pH变化图象如图所示.下列说法不正确的是( )| A. | a点对应的溶液中的溶质是NaCl和HCl | |
| B. | b点对应的溶液中Na+和Cl-的数目相等 | |
| C. | c点对应的溶液中Cl-的质量为0.71克 | |
| D. | 反应过程中生成NaCl的质量始终等于参加反应的HCl和NaOH的质量总和 |
| A. | H2、CO、C具有可燃性,都可以作燃料 | |
| B. | 生石灰、氢氧化钠溶液都能吸收水分,都能作干燥剂 | |
| C. | 浓盐酸、浓硫酸都应密封存放,否则浓度都会变小 | |
| D. | NH4NO3、NH4Cl分别与Ca(OH)2混合研磨都有NH3放出 |
| A. | 铝表面易生成致密氧化铝薄膜,因而具有良好的抗腐蚀性 | |
| B. | 老人缺钙会发生骨质疏松 | |
| C. | 洗涤剂清洗油污的原理是将油污溶解 | |
| D. | 废旧金属的回收利用可减少对环境的污染 |

 人类利用化学变化,合成各种新材料,如合成纤维、合成塑料、合成橡胶等,新材料的应用,极大地促进了人.类社会的发展和人们生活水平的提高,请从化学视角回答下列问题:
人类利用化学变化,合成各种新材料,如合成纤维、合成塑料、合成橡胶等,新材料的应用,极大地促进了人.类社会的发展和人们生活水平的提高,请从化学视角回答下列问题: