题目内容
18.现有A、B、C、D、E、五种装置,按下列要求填空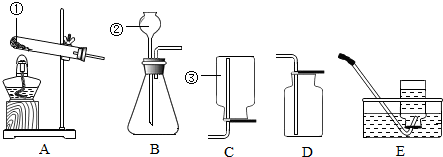
(1)写出图中标号的仪器名称:
①试管,②长颈漏斗,③集气瓶.
(2)实验室用过氧化氢制取氧气,常用二氧化锰写名称)作催化剂,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
反应类型:分解反应;
过氧化氢制取氧气的发生装置可选用B装置(填编号,下同).收集氧气可选用E装置,E装置叫排水法法收集,能用这种方法收集,这种气体必须难溶于水.收集O2也可选用D装置,D装置叫向上排空气法法收集.
(3)实验室用加热分解高锰酸钾制取氧气,制取O2的反应装置可选用A装置(填编号,下同)化学反方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(4)实验室用加热分解氯酸钾制取氧气,化学反方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
分析 (1)根据实验室常用仪器的名称和题中所指仪器作用进行分析;
(2)根据过氧化氢制取氧气时,常用二氧化锰作催化剂,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应物是固体和液体,反应条件是常温,氧气不易溶于水,密度比空气大,可以采用向上排空气法和排水法收集进行分析;
(3)根据实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行分析;
(4)根据氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,①是试管,②是长颈漏斗,③是集气瓶;
(2)过氧化氢制取氧气时,常用二氧化锰作催化剂,过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应满足分解反应一变多的条件,属于分解反应,反应物是固体和液体,反应条件是常温,所以发生装置可选用B装置,氧气不易溶于水,密度比空气大,可以采用向上排空气法和排水法收集;
(3)实验室用高锰酸钾制取氧气的反应物是固体,反应条件是加热,所以反应装置可选用A装置,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
故答案为:(1)试管,长颈漏斗,集气瓶;
(2)二氧化锰,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,分解反应,B,排水法,难,向上排空气法;
(3)A,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(4)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 阅读快车系列答案
阅读快车系列答案| A. | 添加大量的亚硝酸钠来保鲜食品 | |
| B. | 硝酸钾属于盐 | |
| C. | 农业用来配制波尔多液的硫酸铜不属于碱 | |
| D. | 用纯碱除去面粉发酵生成的酸 |
| 名称 | 沸点(t℃) |
| 氮气 | -195.80 |
| 氧气 | -183.00 |
| 氩气 | -186.00 |
| 二氧化碳 | -78.44 |
(2)氮气的沸点比氧气的沸点低;把空气降温加压后,先液化的气体是二氧化碳;液化后升高温度,先逸出的气体是氮气.工业上利用氮气和氧气的沸点不同进行分离液态空气制取大量的氧气,该
方法属于物理变化(填“物理”或“化学”).
| 选项 | 现象或事实 | 解 释 |
| A | 金刚石和石墨的物理性质差异较大 | 两者的原子排列方式不同 |
| B | 酒香不怕巷子深 | 分子不断的运动 |
| C | 活性炭用于做冰箱除味剂 | 是因为活性炭有吸附性 |
| D | 用氯酸钾、高锰酸钾、过氧化氢可以制取氧气 | 是因为这些物质中都含氧气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向某溶液中先滴加稀盐酸,没有明显现象,再滴加氯化钡溶液,生成白色沉淀,则该溶液中一定含有硫酸根离子 | |
| B. | 用玻璃棒蘸取食用白醋滴在润湿pH试纸上,测定其pH | |
| C. | 将H2、O2的混合气体通过盛有灼热氧化铜的试管,以除去氢气 | |
| D. | 除去氯化钠中的硝酸钾,加水后过滤 |
 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是氢氧化钠和氢氧化钙(写一种猜想).
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存.
【实验设计】设计一个简单的实验证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入碳酸钠溶液 | 你的猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑所加的反应物是否过量;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道?在废液中加酸至溶液的pH=7.

