题目内容
17.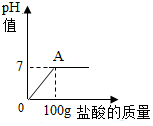 在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:(1)100g稀盐酸中氯化氢的质量7.3g.
(2)完全反应后,计算生成二氧化碳的质量?(写出计算步骤)
(3)完全反应后,所得溶液中溶质的质量分数?(写出计算步骤)
分析 根据图可以看出恰好完全反应时消耗的盐酸的质量,进而求算参加反应的HCl的质量,进而求算参加反应的碳酸钠的质量和生成的二氧化碳以及氯化钠的质量质量,进而求算所得溶液中氯化钠的质量分数.
解答 解:100g稀盐酸中HCl的质量为100g×7.3%=7.3g
恰好完全反应时消耗的HCl的质量为7.3g,设参加反应的碳酸钠的质量为x,生成的二氧化碳的质量为y,生成的氯化钠的质量为z.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 7.3g z y
$\frac{106}{x}$=$\frac{73}{7.3g}$=$\frac{117}{z}$=$\frac{44}{y}$
x=10.6g
y=4.4g
z=11.7g
所得溶液中溶质的质量为13.6g-10.6g+11.7g=14.7g
所得溶液中溶质的质量分数为$\frac{14.7g}{13.6g+100g-4.4g}$×100%≈13.5%.
答:1)100g稀盐酸中氯化氢的质量 7.3g.
(2)完全反应后,计算生成二氧化碳的质量是4.4g.
(3)完全反应后,所得溶液中溶质的质量分数为13.5%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
8.已知,结构相似,在分子组成上相差一个或若干个“CH2”原子团的物质互称为同系物.如甲烷(CH4)和乙烷(C2H6)互为同系物.则下列物质中与乙醇(C2H5OH)互为同系物的是( )
| A. | C4H9OH | B. | CH3COOH | C. | HCHO | D. | C3H8 |
5.下列物质的变化,一定属于化学变化的是( )
| A. | 水力发电 | B. | 食物发霉 | C. | 爆炸 | D. | 海水晒盐 |
12.一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如表:
(1)该反应所属的基本反应类型是化合反应;
(2)该反应中A和B两种物质变化的质量比为3:8.
(1)该反应所属的基本反应类型是化合反应;
(2)该反应中A和B两种物质变化的质量比为3:8.
| 物质 | A | B | C | D |
| 反应前质量/g | 10 | 10 | 10 | 2 |
| 反应后质量/g | 待测 | 2 | 21 | 2 |
2.下列物质在溶液中能大量共存且溶液为无色的是( )
| A. | 氢氧化钠 硫酸铁 氯化铵 | B. | 硝酸钠 氯化钡 氢氧化钙 | ||
| C. | 氢氧化钾 硫酸钠 硝酸铜 | D. | 稀硫酸 硝酸铵 氯化亚铁 |

