题目内容
2.我国石膏储量丰富,如图是以天然石膏(CaSO4•2H2O)和碳酸氢铵为原料制备农用 硫酸铵及副产品X的工艺流程: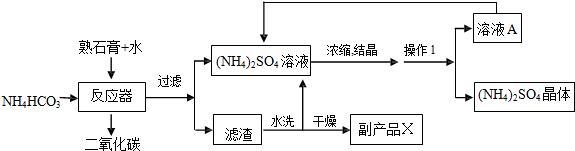
(1)生产时需要对反应器进行加热,但温度不能过高,原因是防止碳酸氢铵受热分解;
(2)副产品X与珍珠的主要成份相同,产品X是碳酸钙(填名称),反应器中反应的化学方程式为2NH4HCO3+CaSO4•2H2O═(NH4)2SO4+CaCO3+CO2↑+3H2O;
(3)操作 1 需要用的仪器是玻璃棒、烧杯、铁架台、漏斗,其中玻璃棒中的作用是引流,溶液 A 可循环使用,溶液 A 是(NH4)2SO4的饱和(填“饱和”或“不饱和”)溶液;
(4)确定滤渣已洗净的方法是取最后一次洗涤液加入氯化钡溶液,无沉淀.
分析 (1)根据碳酸氢铵受热易分解解答;
(2)根据珍珠的主要成份是碳酸钙解答,根据反应写出反应的方程式;
(3)根据过滤操作可以将固体和液体分离,分离沉淀池中CaCO3沉淀和(NH4)2SO4溶液,应采取过滤操作,操作需要的玻璃仪器有漏斗、烧杯和玻璃棒;
(4)根据硫酸铵和氯化钡产生沉淀解答.
解答 解:(1)生产时需要对反应器进行加热,但温度不能过高,原因是防止碳酸氢铵受热分解;
(2)珍珠的主要成份是碳酸钙,副产品X与珍珠的主要成份相同,产品X是碳酸钙,化学方程式为:2NH4HCO3+CaSO4•2H2O=CaCO3↓+(NH4)2SO4+CO2↑+3H2O;
(3)分离沉淀池中CaCO3沉淀和(NH4)2SO4溶液,应采取过滤操作,操作需要的玻璃仪器有漏斗、烧杯和玻璃棒;其中玻璃棒中的作用是引流;溶液A可循环使用,溶液A是(NH4)3SO4的饱和溶液;
(4)硫酸根离子和钡离子会生成硫酸钡沉淀,所以确定滤渣已洗净的方法是:取最后一次洗涤液加入氯化钡溶液,无沉淀.
故答案为:(1)防止碳酸氢铵受热分解;
(2)碳酸钙,2NH4HCO3+CaSO4•2H2O═(NH4)2SO4+CaCO3+CO2↑+3H2O(或2NH4HCO3+CaSO4═(NH4)2SO4+CaCO3+CO2↑+H2O);
(3)漏斗,引流,饱和;
(4)取最后一次洗涤液加入氯化钡溶液,无沉淀.
点评 本题通过一个陌生的反应考查了有关碳酸盐和二氧化碳的知识,因此同学们要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目



 于排水法收集氧气,可在G中装满水后,将氧气从b口(“a”或“b”)进入.
于排水法收集氧气,可在G中装满水后,将氧气从b口(“a”或“b”)进入. 自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.
自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.