题目内容
12.现有4.6g某可燃物与一定量氧气完全反应,生成8.8gCO2和5.4H2O.则该可燃物含有3种元素;反应方程式中O2与CO2、H2O三者化学计量数之比为3:2:3.分析 根据质量守恒定律可知,该物质一定含有氢元素和碳元素,可能含有氧元素;
二氧化碳中碳元素的质量等于8.8g×$\frac{12}{44}$×100%═2.4g:
水中氢元素的质量等于5.4g×$\frac{2}{18}×100%$═0.6g;
因此氢元素和碳元素的质量之和是2.4+0.6═3.0<4.6,则氧元素的质量为4.6g-2.4g-0.6g=1.6g.说明该物质不仅含有碳元素和氢元素,而且含有氧元素.
解答 解:根据质量守恒定律可知,该物质一定含有氢元素和碳元素,可能含有氧元素;
二氧化碳中碳元素的质量等于8.8g×$\frac{12}{44}$×100%═2.4g:
水中氢元素的质量等于5.4g×$\frac{2}{18}×100%$═0.6g;
因此氢元素和碳元素的质量之和是2.4+0.6═3.0<4.6,则说明该物质不仅含有碳元素和氢元素,而且含有氧元素3种元素.氧元素的质量为4.6g-2.4g-0.6g=1.6g.
反应方程式中O2与CO2、H2O三者化学计量数之比为:$\frac{8.8g+5.4g-4.6g}{32}:\frac{8.8g}{44}:\frac{5.4g}{18}$=3:2:3;
答案:3;3:2:3
点评 此题是简单的计算题,首先判断物质的组成,然后判断物质的化学式.要求学生掌握判断物质组成的方法.

练习册系列答案
相关题目
7.对下列实验过程的评价,正确的是( )
| A. | 向某固体中滴加稀盐酸,有气泡产生,该固体一定是碳酸盐 | |
| B. | 在无色溶液中滴入酚酞试液,溶液变红色,该溶液一定是碱的水溶液 | |
| C. | 生石灰块投入水中,水会沸腾,生石灰变成熟石灰的过程是放热反应 | |
| D. | 用小木棍蘸少量浓硫酸,小木棍变黑--浓硫酸有吸水性 |
7. 在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,将5gA与8gB2充分反应,则生成AB2的质量是( )
在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,将5gA与8gB2充分反应,则生成AB2的质量是( )
 在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,将5gA与8gB2充分反应,则生成AB2的质量是( )
在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,将5gA与8gB2充分反应,则生成AB2的质量是( )| A. | 10g | B. | 13g | C. | 16g | D. | 18g |
4.下列反应属于分解反应的是( )
| A. | 乙炔+氧气$\stackrel{点燃}{→}$二氧化碳+水 | |
| B. | 红磷+氧气$\stackrel{点燃}{→}$五氧化二磷 | |
| C. | 高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气 | |
| D. | 分离液态空气得氮气和氧气 |
1.在于谦的《咏石灰》中,哪句诗句中只包含发生了物理变化而不发生化学变化( )
| A. | 千锤百凿出深山 | B. | 烈火焚烧若等闲 | C. | 粉身碎骨浑不怕 | D. | 要留清白在人间 |
 ,则锂原子在化学反应中易失(填“得”或“失”)电子.
,则锂原子在化学反应中易失(填“得”或“失”)电子.
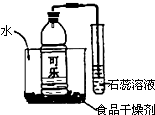 如图是某化学兴趣小组的同学设计的一个趣味实验,其中食品干燥剂的主要成分为生石灰,杂质不考虑.请回答:
如图是某化学兴趣小组的同学设计的一个趣味实验,其中食品干燥剂的主要成分为生石灰,杂质不考虑.请回答: