题目内容
4.一包有Na2S、Na2SO4、Na2SO3三种物质组成的混合物,经分析发现含氧元素的质量为22%,则混合物中硫元素的质量分数是32%.分析 由三种物质的化学式可知:混合物中一共含有三种元素,其中氧元素的质量为22%,所以钠元素和硫元素一共占1-22%=78%,然后我们找到钠元素和硫元素的质量关系即可求得硫元素的质量分数.
解答 解:由题意分析可知在Na2S、Na2SO4、Na2SO3三种物质组成的混合物中一共有三种元素;
经分析发现其中氧元素含量为22%,则钠元素和硫元素的含量共为78%;
由化学式分析可知在混合物中钠元素和硫元素的质量比为(23×2):32=23:16;
所以硫元素的质量分数为$\frac{16}{23+16}×78%$=32%.
故答案为:32%.
点评 在混合物中的元素质量分数的计算题中,不能盲目的直接代入公式计算,跟据告诉的元素的质量分数,求出未知两种元素的总质量分数,然后找到这两种元素的质量关系才能很简单的解决.

练习册系列答案
相关题目
15.新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy,则下列判断正确的是( )
| A. | MFe2Ox是还原剂 | B. | SO2是该反应的催化剂 | ||
| C. | x<y | D. | SO2发生了分解反应 |
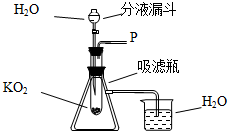 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动. 淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状,提出问题并在实验室进行了以下探究.
淡水资源的缺乏已成为制约社会发展的重要因素,从浩瀚的海洋里获取淡水,对解决淡水危机具有重要意义.某小组针对这一现状,提出问题并在实验室进行了以下探究.

