题目内容
13. 2016年12月26日,合肥地铁一号线正式通车,实现了我省地下交通的新突破.根据如图回答下列问题:
2016年12月26日,合肥地铁一号线正式通车,实现了我省地下交通的新突破.根据如图回答下列问题:(1)图中所示材料中,属于金属材料的是钛合金或钢(填一种即可,下同);属于有机合成材料的是塑料;石墨
电刷的使用主要利用其导电性.
(2)地铁车身的表面都喷上一层油漆,目的 是为了防止铁与空气中的水和氧气发生反应而生锈.
(3)轨道交通的发展与炼钢工艺的发展密不可分,钢和生铁都是铁的合金,它们的区别
在于钢的含碳量低于(填“高于”或“低于”)生铁.合金跟纯金属相比,其组成和内部结构发生变化,从而引起硬度的变化(填一条物理性质即可).
分析 (1)根据材料的分类以及物质的性质来分析解答;
(2)根据铁生锈的条件来分析;
(3)根据生铁和钢的含碳量以及结构决定性质来分析.
解答 解:(1)金属材料包括纯金属与合金,则钛合金和钢属于金属材料;有机合成材料包括塑料、合成纤维和合成橡胶,所以塑料属于有机合成材料;石墨具有导电性,可以用来制电刷;故填:钛合金或钢;塑料;导电;
(2)喷上油漆是为了防止铁与水和氧气接触发生反应而生锈,故填:水和氧气;
(3)生铁的含碳量在2%-4.3%之间,钢的含碳量在0.02%-2%之间,钢的含碳量低于生铁;合金跟纯金属相比,其组成和内部结构发生变化,从而引起硬度、熔点等物理性质的改变;故填:低于;硬度.
点评 本题考查的是常见的金属的应用,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列有关化学史的叙述错误的是( )
| A. | 拉瓦锡得出了空气是由氧气和氮气组成的结论 | |
| B. | 俄国化学家门捷列夫制得了第一张元素周期表 | |
| C. | 汤姆森发现了电子,证实原子是可分的 | |
| D. | 我国化学家侯德榜在工业制烧碱的研究中取得了巨大成就 |
18.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质.工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如(图1)所示.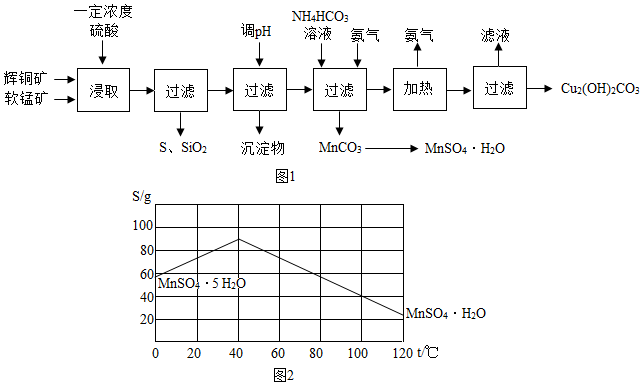
已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
(1)酸浸时,为了提高浸取率可采取的措施有矿石粉碎或者适当升高温度或者搅拌(任写一点);酸浸过程中,硫酸、MnO2与Cu2S的化学反应方程式为2MnO2+Cu2S+4H2SO4=2CuSO4+S+4H2O+2MnSO4.
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)

已知:①硫酸、MnO2与Cu2S反应生成硫酸铜、MnSO4和单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如表所示:
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(2)调节浸出液pH的范围为1.1~3.2,其目的是使铁离子转化为氢氧化铁沉淀除去;
(3)本工艺中可循环使用的物质是NH3(写化学式).
(4)NH4HCO3溶液、氨气与MnSO4反应生成MnCO3和一种铵盐,且化学方程式为NH4HCO3+NH3+MnSO4=MnCO3↓+(NH4)2SO4;
(5)碳酸锰可转化为硫酸锰溶液,试根据(如图2)曲线图示,由硫酸锰溶液结晶出MnSO4•H2O的最低温度是
40℃;若由硫酸锰溶液结晶出MnSO4•5H2O的最佳温度是:0℃(上述两个温度均在图中所示范围内选取)





 如图为某化学兴趣小组同学设计的观察铁制品锈蚀的实验装置,下列叙述正确的是
如图为某化学兴趣小组同学设计的观察铁制品锈蚀的实验装置,下列叙述正确的是
