题目内容
15.某炼钢厂废气中含SO2为0.32g/L,SO2可以用混有CuO的CuSO4稀溶液吸收,得到CuSO4浓溶液,反应的化学方程式为:2CuO+2SO2+O2═2CuSO4.(1)1000L该厂废气中含有SO2的质量为320 g.
(2)若该厂用足量CuO和足量的含CuSO4100g的CuSO4稀溶液处理1000L废气(假设SO2完全被吸收).请计算反应后溶液中CuSO4的质量.
分析 (1)根据废气中二氧化硫的含量即可解答;
(2)根据已有的知识进行分析,相对分子质量就是化学式中各元素相对原子质量的总和;根据反应的化学方程式,找出已知物质和待求物质,进行解答即可.
解答 解:(1)1000L该厂废气中含有SO2的质量为1000L×0.32g/L=320g;
(2)设:生成硫酸铜的质量为x.
2CuO+2SO2+O2═2CuSO4
128 320
320 g x
$\frac{128}{320g}=\frac{320}{x}$
x=800 g
反应后溶液中硫酸铜的质量为:100 g+800 g=900 g
答:反应后溶液中硫酸铜的质量为900 g.
点评 本题考查了根据化学式以及根据化学方程式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
16.小王要制备纯净的二氧化碳气体.可供选用的仪器如图所示.可供选用的药品如下:①石灰石②澄清石灰水③稀硫酸④浓硫酸⑤盐酸溶液⑥烧碱溶液⑦蒸馏水.下列装置连接顺序及组合最恰当的是( )

| A. | A(①⑤)、B(④)、C(⑦)、D | B. | A(①③)、B(④)、C(⑦)、D | C. | A(①⑤)、B(⑦)、C(④)、D | D. | A(①⑤)、B(⑥)、C(④)、D |
6.某气体由氢气、一氧化碳、甲烷中的一种或几种组成.点燃该气体后,在火焰上方罩一冷而干燥的烧杯,烧杯内壁出现水雾;把烧杯迅速倒转过来,注入少量澄清石灰水,振荡,石灰水变混浊.下列对气体组成的推断错误的是( )
| A. | 可能只有氢气一种气体 | B. | 可能三种气体都存在 | ||
| C. | 可能是甲烷和一氧化碳的混合气体 | D. | 可能只有甲烷一种气体 |
7.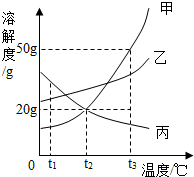 图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
 图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | 升高温度可以将接近饱和的丙溶液变为饱和溶液 | |
| C. | t3℃的甲、丙两物质的饱和溶液降温到t2℃时,所得溶液的溶质质量分数相等 | |
| D. | t2℃时,50g水中加入15g甲物质,所得溶液的溶质质量分数约为16.7% |
4.据报道,科学家已成功合成了少量N4.有关N4的说法中正确的是( )
| A. | N4的摩尔质量是56g | |
| B. | N4与N2互为同素异形体 | |
| C. | N4与N2稳定 | |
| D. | 等物质的量的N4与N2所含分子个数比为2:1 |
 豆腐是生活中常见的食品,主要成分如右图所示.
豆腐是生活中常见的食品,主要成分如右图所示. 腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).
腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).