题目内容
10.NaNO2(亚硝酸钠)、NaCl和物质M(不含结晶水)的溶解度曲线如图①所示,请根据图象和有关信息回答下列问题: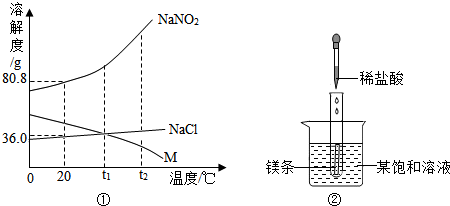
(1)如图②所示,当往试管中加人5mL稀盐酸时,试管内立刻产生大量气泡,同时放热使烧杯中饱和溶液变浑浊(不考虑水分蒸发).请判断:该饱和溶液中的溶质是NaNO2、NaCl和M中的M.
(2)分别将NaNO2、NaCl和M的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是NaNO2>NaCl>M.
(3)NaNO2有毒,其外观和咸味与食盐很相似,因此要防止因误食NaNO2而发生中毒事故.为了区别NaNO2、NaCl固体,某化学兴趣小组同学查问资料获得如下信息:NaNO2的水溶液呈碱性、NaCl的水溶液呈中性;NaNO2熔点为271℃,NaCl熔点为801℃.
①小明同学设计的鉴别实验方案如下:20℃时分别取NaNO2、NaCl各5.0g于两只小烧杯中,分别加人10mL水(水的窗度近似看做1g/cm3),用玻璃棒充分搅拌后观察.你认为此方案是否可行可行(填“可行”或“不可行”).
②小芳同学又设计出与小明同学不同的实验方案,该方案如下:分别取NaNO2、NaCl各少量于两只试管中,分别加水充分溶解,分别滴加硝酸银溶液,观察现象,有白色沉淀生成的原固体是NaCl,另为NaNO2.同学们认为此方法不可行,你认为还需要收集的证据是亚硝酸钠能否与硝酸银反应生成白色沉淀.
分析 (1)镁条放热使烧杯中饱和溶液变浑浊,说明该物质的溶解度随温度的升高而减小,有溶质析出,并结合三种物质的溶解度曲线分析即可;
(2)据溶解度曲线可比较同一温度时物质的溶解度大小;
(3)据氯化钠和亚硝酸钠两种物质的溶解度曲线随温度的变化情况以及亚硝酸钠能否与硝酸银反应生成白色沉淀分析解答.
解答 解:(1)镁条放热使烧杯中饱和溶液变浑浊,说明该物质的溶解度随温度的升高而减小,有溶质析出,而M 的溶解度随温度的升高而减小,其他两种物质的溶解度随温度的升高而增大,故该物质是M,故填:M;
(2)由图可知:t2℃时,NaNO2、NaCl和M的溶解度由大到小的顺序是NaNO2>NaCl>M,故填:NaNO2>NaCl>M;
(3)①20℃时NaNO2的溶解度大于NaCl的溶解度,根据10mL水中溶解固体质量的大小可以判断出亚硝酸钠和氯化钠,故填:可行;
②因为不知道亚硝酸钠能与硝酸银反应生成白色沉淀,所以该方案不可行,故填:亚硝酸钠能否与硝酸银反应生成白色沉淀.
点评 本题考查的是溶解度曲线及其应用,完成此题,可以依据已有的知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1. 化学服务于生活.如表是生活中常用物质溶液的pH,请用化学符号填空:
化学服务于生活.如表是生活中常用物质溶液的pH,请用化学符号填空:
(1)可用于制“叶脉书签”的碱:NaOH(填化学式).
(2)当你被蚊虫叮咬(释放一种酸性物质)后,为减轻疼痛,可在叮咬处涂NaHCO3(填化学式);
(3)酸、碱、盐溶液中发生的反应实质是溶液中的离子反应.酸溶液有相似的性质因为溶液中有共同的H+(填离子符号);碱溶液有相似的性质是溶液中OH-(填离子符号)表现出来的性质
(4)从微观角度认识物质及其变化有助于了解物质的组成及其变化的本质.如图表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+和OH-结合生成水.请写出一个与上述反应本质相同的化学方程式:H2SO4+2KOH═K2SO4+2H2O.
 化学服务于生活.如表是生活中常用物质溶液的pH,请用化学符号填空:
化学服务于生活.如表是生活中常用物质溶液的pH,请用化学符号填空:| 序号 | A | B | C | D | E |
| 名称 | 食醋 | 白酒 | 白糖水 | 烧碱 | 小苏打溶液 |
| 溶液pH | 3 | 7 | 7 | 11 | 8 |
(2)当你被蚊虫叮咬(释放一种酸性物质)后,为减轻疼痛,可在叮咬处涂NaHCO3(填化学式);
(3)酸、碱、盐溶液中发生的反应实质是溶液中的离子反应.酸溶液有相似的性质因为溶液中有共同的H+(填离子符号);碱溶液有相似的性质是溶液中OH-(填离子符号)表现出来的性质
(4)从微观角度认识物质及其变化有助于了解物质的组成及其变化的本质.如图表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+和OH-结合生成水.请写出一个与上述反应本质相同的化学方程式:H2SO4+2KOH═K2SO4+2H2O.
15.下列物质由分子构成的是( )
| A. | 金刚石 | B. | 水 | C. | 氯化钠 | D. | 铁 |
2.下列几种气体中约占空气总体积78%的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 氮气 | D. | 稀有气体 |
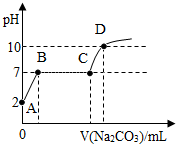 实验室制取CO2后残留溶液的pH为2,向该溶液中滴入Na2CO3溶液可得如图曲线,则AB段反应的方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;BC段反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl;CD段上升的原因是过量的碳酸钠溶液使溶液的碱性增强(合理即可).
实验室制取CO2后残留溶液的pH为2,向该溶液中滴入Na2CO3溶液可得如图曲线,则AB段反应的方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;BC段反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl;CD段上升的原因是过量的碳酸钠溶液使溶液的碱性增强(合理即可). 燃气热水器(如图所示)是家庭常用热水器.
燃气热水器(如图所示)是家庭常用热水器.