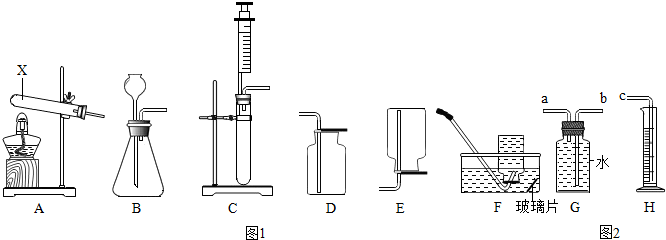
题目内容
20.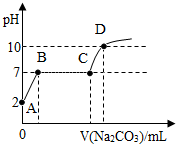 实验室制取CO2后残留溶液的pH为2,向该溶液中滴入Na2CO3溶液可得如图曲线,则AB段反应的方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;BC段反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl;CD段上升的原因是过量的碳酸钠溶液使溶液的碱性增强(合理即可).
实验室制取CO2后残留溶液的pH为2,向该溶液中滴入Na2CO3溶液可得如图曲线,则AB段反应的方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;BC段反应的方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl;CD段上升的原因是过量的碳酸钠溶液使溶液的碱性增强(合理即可).
分析 实验室制取CO2后残留溶液的pH为2,显酸性,则残留溶液是氯化钙与盐酸的混合溶液;结合图象,向该溶液中滴入Na2CO3溶液,AB段pH由2增加至7,盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳;碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,生成的氯化钠溶液显中性,故BC段pH不变;完全反应后,继续滴加碳酸钠,碳酸钠溶液显碱性,据此进行分析解答.
解答 解:实验室制取CO2后残留溶液的pH为2,显酸性,则残留溶液是氯化钙与盐酸的混合溶液;向该溶液中滴入Na2CO3溶液,盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,AB段pH由2增加至7,反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
继续滴加碳酸钠溶液,碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,生成的氯化钠溶液显中性,故BC段pH不变,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl.
完全反应后,继续滴加碳酸钠,碳酸钠溶液显碱性,随着碳酸钠溶液的质量的增加,碱性增强,故CD段pH上升.
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCl2+Na2CO3═CaCO3↓+2NaCl;过量的碳酸钠溶液使溶液的碱性增强(合理即可).
点评 本题难度不大,掌握盐的化学性质、实验室制取CO2后残留溶液的主要成分、溶液的酸碱性和溶液pH大小之间的关系是正确解答本题的关键.

练习册系列答案
相关题目
10.实验室里常用双氧水和二氧化锰制取氧气,在该反应中,二氧化锰的作用是( )
| A. | 反应物 | B. | 催化剂 | C. | 反应物和催化剂 | D. | 生成物 |
11.表列出了除去物质中所含少量杂质的方法,其中正确的选项是正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | 铝粉 | 铁粉 | 加入过量稀盐酸,过滤 |
| B | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
| C | 氯化钾 | 氯酸钾 | 加热 |
| D | 氢氧化钠溶液 | 碳酸钠 | 加入适量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
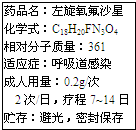 新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.
新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图.