题目内容
11.下列实验操作错误的是( )| A. |  稀释浓硫酸 | B. |  胶头滴管吸取液体 | ||
| C. |  读取液体体积 | D. |  检查氢气的纯度 |
分析 A、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断
B、根据胶头滴管的使用方法,进行分析判断.
C、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断.
D、根据检验氢气纯度的方法,进行分析判断.
解答 解:A、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
B、为防止污染胶头滴管,使用滴管的过程中不可平放或倒置滴管,图中所示操作错误.
C、量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中所示操作正确.
D、检验氢气纯度的方法:用排水法收集一试管氢气,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指点火,如果听到尖锐的爆鸣声,表明氢气不纯,需要再收集,再检验,直到听到很小的响声,才表明氢气已经纯净,图中所示装置正确.
故选:B.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
2.菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中镁元素的含量,某班学习小组进行了实验探究,取10g菱镁矿样品,逐渐加入未知浓度的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
注:菱镁矿中的杂质不溶于水,不与酸发生反应、不含镁元素.请回答:
(1)10g菱镁矿与稀硫酸完全反应,生成气体的质量为4.4g.
(2)计算该菱镁矿中镁元素的质量分数.(写出计算过程)
(3)吸收反应生成的气体,不用石灰水的原因是氢氧化钙的溶解度常温下很小,所以等质量的石灰水和氢氧化钠溶液中,氢氧化钠溶液的质量分数更大,可吸收更多的二氧化碳.
| 分组 | 1 | 2 | 3 | 4 |
| 加入H2SO4溶液质量/g | 50 | 100 | 150 | 200 |
| NaOH溶液增加质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(1)10g菱镁矿与稀硫酸完全反应,生成气体的质量为4.4g.
(2)计算该菱镁矿中镁元素的质量分数.(写出计算过程)
(3)吸收反应生成的气体,不用石灰水的原因是氢氧化钙的溶解度常温下很小,所以等质量的石灰水和氢氧化钠溶液中,氢氧化钠溶液的质量分数更大,可吸收更多的二氧化碳.
19.金属单质M与硫在一定条件下发生如下反应:2M+S═M2S甲乙两组同学分别进行实验,加入的 M与S的质量各不相同充分反应后实验数据记录如下:
分析数据回答问题
(1)两组同学实验中参加反应的M的质量是6.0g,参加反应的S的质量是1.5g.
(2)计算M的相对原子质量?(写出计算过程)
| 物质 | M的质量/g | S的质量/g | M2S的质量/g |
| 甲 | 6.0 | 2.5 | 7.5 |
| 乙 | 7.0 | 1.5 | 7.5 |
(1)两组同学实验中参加反应的M的质量是6.0g,参加反应的S的质量是1.5g.
(2)计算M的相对原子质量?(写出计算过程)
3.一些食物近似pH如表
则下列说法不正确的是( )
| 食物 | 番茄 | 牛奶 | 鸡蛋清 | 苹果汁 |
| pH | 4.0~4.4 | 6.3~6.6 | 7.6~8.0 | 2.9~3.3 |
| A. | 胃酸过多的人应少食苹果 | B. | 番茄汁显酸性 | ||
| C. | 牛奶和鸡蛋清均显碱性 | D. | 苹果汁酸性比牛奶强 |

 化学与我们的生活密切相关.
化学与我们的生活密切相关.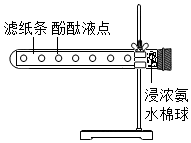 裁取一条滤纸,用玻璃棒醮取酚酞试液,在滤纸上均匀点若干液点,将滤纸塞入试管内,试管口用脱脂棉塞住.用滴管向脱脂棉上滴加适量的浓氨水,再塞上塞子,观察.(如图)
裁取一条滤纸,用玻璃棒醮取酚酞试液,在滤纸上均匀点若干液点,将滤纸塞入试管内,试管口用脱脂棉塞住.用滴管向脱脂棉上滴加适量的浓氨水,再塞上塞子,观察.(如图)