题目内容
18.回答有关金属的问题.(1)阴雨天防雷电,远离金属,这是因为金属具有的性质是导电性;
(2)用稀盐酸除铁锈,有关反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
(3)质量为200t含氧化铁70%的赤铁矿石,其含有铁元素的质量至少为112t;
(4)向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得滤液和滤渣,下列说法中正确的是AB.
A.滤液可能呈蓝色 B.滤液中一定含有Zn2+ C.滤渣中一定含有Fe、Cu.
分析 (1)根据金属具有导电性分析回答;
(2)根据盐酸能与金属氧化物反应写出反应的化学方程式;
(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答;
(4)在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此分析判断.
解答 解:(1)由于金属具有导电性,所以阴雨天防雷电,远离金属;
(2)铁锈的主要成份是氧化铁能与稀盐酸反应生成了氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O;
(3)质量为200t含氧化铁70%的赤铁矿石,其含有铁元素的质量至少为:200t×70%×$\frac{56×2}{56×2+16×3}$×100%=112t.
(4)在金属活动性顺序中,铜、锌、铁的活动性顺序为锌>铁>铜.所以向FeSO4和CuSO4的混合溶液中投入一些锌粉,锌先与硫酸铜反应生成硫酸锌和铜,当硫酸铜完全反应后再与硫酸亚铁反应生成了硫酸锌和铁,由此可知:
A.当溶液中的硫酸不能完全反应时,滤液呈蓝色,故A正确;
B.由于锌参加了反应,滤液中一定含有Zn2+,故B正确;
C.当溶液中的硫酸铜不能完全反应时,滤渣中不含有铁,故C错误.
故选:(1)导电;(2)Fe2O3+6HCl═2FeCl3+3H2O;(3)112t;(4)AB.
点评 本题主要考查金属的导电性、化学式的计算、方程式的书写和金属活动性顺序,考查的知识点较多,但难度不大,都是课本中的基础知识,应加强基础知识的学习,有利于解答本类题.

练习册系列答案
相关题目
9.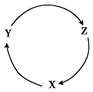 自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( )
自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( )
 自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( )
自然界的物质会发生变化,且变化有一定规律.根据物质转化的规律判断,下列各组物质中,能满足下图一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | H2 | O2 | H2O |
| B | Cu | CuO | CuSO4 |
| C | C | CO2 | CO |
| D | CO2 | Na2CO3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
13.下列物质的用途与化学性质相关的是( )
| A. | 金刚石制作玻璃刀 | B. | 用熟石灰改良酸性土壤 | ||
| C. | 用干冰作制冷剂 | D. | 用活性炭吸附冰箱内的异味 |
7.我国科学家利用石墨烯(一种由碳原子构成的物质)与铝合金,研制出一种具备特殊性能的烯合金,下列对烯合金和石墨烯的说法错误的是( )
| A. | 烯合金是一种新型材料 | B. | 烯合金具有优良的导电性 | ||
| C. | 石墨烯在常温下化学性质活泼 | D. | 石墨烯在一定条件下能与氧气反应 |
8.实验室中利用过氧化氢、氯酸钾、高锰酸钾都可以制取氧气,其原因是( )
| A. | 三种物质都是氧化物 | B. | 三种物质都含有氧元素 | ||
| C. | 三种物质都含有氧分子 | D. | 三种物质都含有氧气 |