题目内容
1.某研究小组对用H2O2分解生成H2O和O2的实验条件进行探究.他们进行了以下实验:①往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃复燃.
②往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃.
③往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃.
④经检验,②③中反应后试管中仍分别含有a g MnO2和a g Fe2O3.
问题:(1)MnO2、Fe2O3在上述反应中的作用是催化作用.
(2)实验②④中H2O2的浓度(w%)以5%为宜.
研究小组还对溶液浓度、催化剂的种类等实验条件进行了探究.下表选取了部分实验数据:
用足量等体积H2O2溶液制取相同体积O2所需的时间
| 时间 (min) 浓度 条件 | 30%H2O2 | 15%H2O2 | 5%H2O2 |
| 加入agMnO2 | 0.2 | 0.8 | 2.0 |
| 加入agFe2O3 | 7.0 | 9.0 | 16.0 |
分析 (1)根据催化剂所起的作用考虑;
(2)根据图表中数据找出反应速度快的溶质质量分数;
(3)由图中数据进行对比找出反应速度的影响因素即可.
解答 解:(1)往盛有5mL 5% H2O2溶液的试管中,伸入带火星的木条,木条不复燃,说明产生的氧气很少,往盛有5mL w% H2O2溶液的试管中,加入a g MnO2,伸入带火星的木条,木条复燃,说明二氧化锰加快了过氧化氢分解的速度,往盛有5mL w% H2O2溶液的试管中,加入a g Fe2O3,伸入带火星的木条,木条复燃,说明氧化铁也加快了过氧化氢分解的速度,并且在反应前后质量不变,所以二氧化锰和氧化铁可以作为过氧化氢分解的催化剂,催化剂所起的作用叫催化作用;
(2)作对照实验,必须只有一个变量,有没有催化剂属于变量,所以过氧化氢的质量分数必须相同,过氧化氢溶液的溶质质量分数需要5%;由图表中数据可知过氧化氢制取氧气时二氧化锰作催化剂要比氧化铁作催化剂反映的速度快;由图表中数据可知过氧化氢溶液的浓度越大反应速度越快.
答案:
(1)催化作用;
(2)5%;
(3)相同条件下,MnO2的催化效果比Fe2O3好;在其他条件相同的情况下,H2O2浓度越大,产生氧气的速度越快
点评 解答本题关键是要知道催化剂所起的作用,学会根据图表中数据找规律的方法.

练习册系列答案
相关题目
10.向工厂排放出的一澄清废液中,加入BaCl2溶液,产生白色沉淀,再加入足量的硝酸,沉淀部分溶解并产生能使澄清的石灰水变浑浊的气体,则下列说法正确的是( )
| A. | 废液中一定含有Ag+ | B. | 废液中一定含有CO32- | ||
| C. | 废液中一定含有SO42- | D. | 废液中一定含有H2SO4 |
9. 有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:
有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:
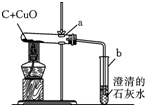
通过实验及分析,确定该粉末为氧化铜和碳粉混合物,为了进一步探究它们的性质,探究小组又利用这种混合物补充做了如图所示实验:
①试管a中的化学方程式为C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
②氧化铜和碳反应属于置换反应(填基本反应类型).
③最能说明a试管中氧化铜和碳已完全反应的实验现象是b中的导管口不再产生气泡.
 有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:
有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含C |
①试管a中的化学方程式为C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
②氧化铜和碳反应属于置换反应(填基本反应类型).
③最能说明a试管中氧化铜和碳已完全反应的实验现象是b中的导管口不再产生气泡.
10.在日常生活中,下列做法错误的是( )
| A. | 正常人每天都应摄入一定量的蛋白质 | |
| B. | 做馒头时,常在发酵后的面团中加入适量的纯碱,使蒸熟的馒头疏松多孔 | |
| C. | 包装食品使用聚氯乙烯塑料袋,可以用加热的方法封口 | |
| D. | 厨房洗涤剂具有乳化功能,常用来除去餐具上的油污 |
11.常用的“灭火弹”里装有液态四氯化碳.使用时,液态四氯化碳迅速转化为气态并覆盖在火焰上使火熄灭.下列有关说法错误的是( )
| A. | “灭火弹”灭火的主要原理是降低燃烧物的着火点 | |
| B. | 液态四氯化碳转化为气态时分子间的间隔变大 | |
| C. | 四氯化碳不能燃烧也不支持燃烧 | |
| D. | 气态四氯化碳的密度比空气大 |

 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来. 1860年,英国化学家法拉第在为少年儿童所作的化学讲座中做了一个有趣的“母子火焰”实验.回答下列问题:
1860年,英国化学家法拉第在为少年儿童所作的化学讲座中做了一个有趣的“母子火焰”实验.回答下列问题: