题目内容
8.有一白色粉末,其中只可能含有硫酸镁、碳酸钠、硫酸铜、氯化钠、氯化镁中的一种或几种.根据以下实验回答.(1)取样,加水溶解得无色溶液A,向A中加入足量稀硝酸,无现象,得无色溶液B.则该粉末中一定没有硫酸铜、碳酸钠.
(2)向溶液B中加入足量硝酸钡溶液,得到23.3g白色沉淀和无色溶液C,则原白色粉末中含有硫酸镁.
(3)为确定是否含有另外两种物质,将C溶液平均分成两份,向一份中加入足量的硝酸银得到14.35g白色沉淀;向另一份溶液中加入足量氢氧化钠溶液得到5.8g白色沉淀.则原白色粉末中还一定含有氯化钠,一定没有氯化镁.
分析 (1)考虑如果含有硫酸铜,铜离子在溶液中,溶液应为蓝色;考虑碳酸根离子与酸反应生成气体;
(2)考虑Ba(NO3)2+MgSO4=BaSO4↓+Mg(NO3)2,进行分析;
(3)根据生成的氯化银沉淀的质量,结合反应的化学方程式可计算出原固体混合物中的氯化钠的质量和硝酸银溶液中的硝酸银的质量,进而计算出原混合物中硫酸镁、氯化钠的质量即可.
解答 解:
有一白色粉末,其中只可能含有硫酸镁、碳酸钠、硫酸铜、氯化钠、氯化镁中的一种或几种.根据以下实验回答:(1)取样,加水溶解得无色溶液A,向A中加入足量稀硝酸,无现象,得无色溶液B.因为如果含有硫酸铜,铜离子在溶液中,溶液应为蓝色;而碳酸根离子与酸反应生成气体,则该粉末中一定没有硫酸铜、碳酸钠.
(2)根据(1)推测,溶液B中成分可能为稀硝酸、硫酸镁、氯化钠、氯化镁,其中加入足量硝酸钡溶液,得到23.3g白色沉淀和无色溶液C,根据Ba(NO3)2+MgSO4=BaSO4↓+Mg(NO3)2,则原白色粉末中含有硫酸镁.
(3)根据(2)推测,无色溶液C可能为稀硝酸、Mg(NO3)2、氯化钠、氯化镁,为确定是否含有另外两种物质“氯化钠、氯化镁”,将C溶液平均分成两份,向一份中加入足量的硝酸银得到14.35g白色沉淀,则可知一定有氯离子;
根据Ba(NO3)2+MgSO4=BaSO4↓+Mg(NO3)2,
233 148,因为23.3g白色沉淀BaSO4,则可知Mg(NO3)2的质量为14.8g,
根据2NaOH+Mg(NO3)2=2NaNO3+Mg(OH)2↓,
148 58,因为14.8gMg(NO3)2,则可知生成沉淀Mg(OH)2的质量为5.8g,故可知:则原白色粉末中还一定含有氯化钠,一定没有氯化镁.
故答案为:
(1)硫酸铜、碳酸钠;(2)硫酸镁(3)氯化钠,氯化镁.
点评 本考点属于物质的鉴别题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论.本考点是中考的重要内容之一,主要出现在填空题和实验题中.

 名校课堂系列答案
名校课堂系列答案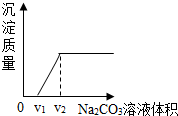 某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.
某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究.探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告.
| 方案 | (1) | (2) | (3) |
| 实验操作 | 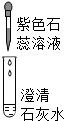 | 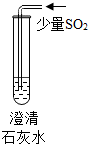 |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 SO2+Ca(OH)2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
【查阅资料】氯化钙溶液呈中性.
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙;②氯化钙和氯化氢;③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是稀盐酸加入滴有酚酞的石灰水中,红色褪为无色,说明溶液为中性或酸性,不可能有氢氧化钙,故猜想③肯定不合理;.
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴边振荡.实验后得出产生沉淀质量与滴加碳酸钠溶液体积之间的关系,如图所示.写出实验过程中的现象滴加碳酸钠溶液,开始先产生气泡,随后才产生沉淀,溶液最终变红色.
【得出结论】乙同学的猜想中,②(填序号)合理.
【反思讨论】学习小组结合图象,分析了丁同学实验过程中烧杯内溶液的变化.下列说法正确的是AB.(填序号)
A.溶液质量逐渐增大 B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小 D.溶液的pH一直在增大.
| A. | 铜片插入稀硫酸:Cu+H2SO4═CuSO4+H2↑ | |
| B. | 工业炼铁:FexOy+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2 | |
| C. | 氢氧化钠溶液吸收二氧化硫:2NaOH+SO2═Na2SO4+H2O | |
| D. | 二氧化碳通入氯化钙溶液:CO2+CaCl2+H2O═CaCO3↓+2HCl |
| A. | 铜具有导电性 | B. | 氢氧化钙能与稀盐酸反应 | ||
| C. | 碳酸钠是白色固体 | D. | 常温下甲烷是无色无味气体 |
 在实验室里用浓度为98%的浓硫酸和蒸馏水配制稀硫酸.
在实验室里用浓度为98%的浓硫酸和蒸馏水配制稀硫酸.

