题目内容
3.科学课上,老师告诉学生“能发生复分解反应的两种盐通常是可溶的”.有“通常”就有“例外”,能否找到某些可溶性盐和难溶性盐发生复分解反应的证据呢?科学兴趣小组进行了探究.【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行.
②了解到某些难溶性盐的溶解能力和颜色.
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成.
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀.
【分析讨论】(1)为什么要加入过量的NaCl溶液?请说明理由.使银离子全部沉淀
(2)写出加入少量KI溶液后发生反应的化学方程式.KI+AgCl=AgI↓+KCl
(3)该反应能发生的原因是AgI在水中的溶解能力小于AgCl(选填“大于”、“等于”或“小于”).
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应.
分析 根据物质间的反应以及物质的性质进行分析解答即可.
解答 解:(1)加入过量的氯化钠能保证将银离子全部沉淀,故填:使银离子全部沉淀;
(2)碘化钾能与白色氯化银反应生成碘化银沉淀和氯化钾,故填:KI+AgCl=AgI↓+KCl;
(3)因为氯化银能转化生成碘化银,说明碘化银的溶解能力小于氯化银,故填:小于.
点评 本题考查的是化学反应的类型以及特点,完成此题,可以依据复分解反应的实质进行.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
16.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  滴加液体 | C. |  取固体药品 | D. |  点燃酒精灯 |
14.下列四个图象中,能正确表示对应变化关系的是( )
| A. |  加热一定量氯酸钾固体 | |
| B. |  向接近饱和的硝酸钾溶液中加入硝酸钾 | |
| C. |  向一定量稀硫酸中加水 | |
| D. |  将等质量铁、锌分别与足量稀盐酸混合 |
11.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-和SO${\;}_{4}^{2-}$离子的一种或几种.为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成.继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的滤液中滴加Na2CO3溶液,又观察到沉淀生成.
分析实验得出的以下结论中,正确的是( )
| A. | 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO${\;}_{4}^{2-}$ | |
| B. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO${\;}_{4}^{2-}$ | |
| C. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Na+ | |
| D. | 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Cl- |
18.下列图象能正确反映其对应的实验操作的是( )
| A. |  向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液 | |
| B. |  向盛有一定量的氯化钙与盐酸混合溶液的烧杯中逐滴加入碳酸钠溶液至过量 | |
| C. |  常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应 | |
| D. |  相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,期中一份加入少量MnO2 |
8.下列有关金属材料说法正确的是( )
| A. | 铁片在海水中不易生锈 | B. | 钢是纯铁 | ||
| C. | 铝片表面易生成一层致密的氧化膜 | D. | 纯铜硬度高于黄铜(铜锌合金) |
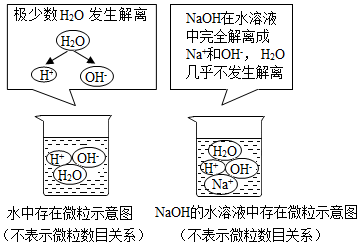
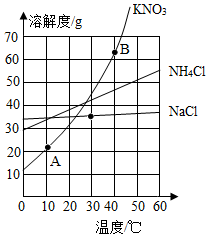 酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
酸、碱、盐是重要的化合物,研究它们的性质有重要意义.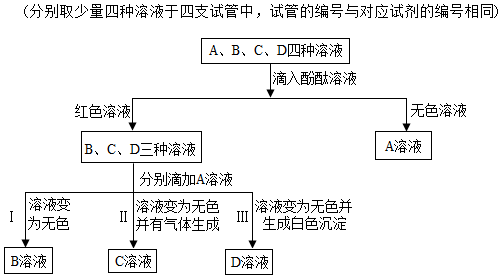
 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”.小柯将硫酸镁溶液滴入硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变化情况.图线AB段对应的实验现象是产生白色沉淀,C点处溶液中的溶质有Mg(NO3)2和MgSO4.
硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”.小柯将硫酸镁溶液滴入硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变化情况.图线AB段对应的实验现象是产生白色沉淀,C点处溶液中的溶质有Mg(NO3)2和MgSO4.