题目内容
4.水煤气是将水蒸气通过灼热的焦炭而生成的气体,主要成分是一氧化碳、氢气及少量的二氧化碳和水蒸气.某课题组同学为验证水煤气的成分,做了以下准备:(一)资料收集:
①H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
②CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2
③无水硫酸铜遇水由白色变为蓝色
(二)设计实验装置

请分析上面信息后回答:
①你认为验证水煤气中各成分的顺序依次是H2O、CO2、H2、CO;
②装置C的目的是吸收二氧化碳气体,装置D的作用是除去水蒸气;
③装置E内观察到的现象是反应物由黑色变成红色;
④实验中两次用到装置A,其目的分别是验证水煤气含有水蒸气,通过验证生成物中有水蒸气来证明水煤气中含有氢气.
分析 ①实验室中常用无水硫酸铜遇水由白色变为蓝色来验证水,澄清的石灰水来验证二氧化碳,通过黑色的氧化铜转变成红色的铜来验证有还原性的物质存在;
②实验室常用氢氧化钠溶液来吸收二氧化碳,用浓硫酸来干燥气体;
③根据氢气、一氧化碳与氧化铜的反应分析;
④实验中两次用到装置A,其目的是不同的,第一次用到装置A,其目的是验证水煤气含有水蒸气,第二次用到装置A,其目的是:生成物中有水蒸气来证明水煤气中含有氢气.
解答 解:①由题意可知,无水硫酸铜由白色变为蓝色、澄清的石灰水变浑浊、黑色的氧化铜转变成红色的铜及
无水硫酸铜由白色变为蓝色、澄清的石灰水变浑浊,分别验证水煤气中各成分的顺序依次是:H2O、CO2、H2、CO;
②由于氢氧化钠能与二氧化碳反应,装置C的目的是:吸收二氧化碳.浓硫酸具有吸水性,装置D的作用是:除去水蒸气;
③氧化铜是黑色的铜石红色的,在加热的条件下,一氧化碳和氢气能将氧化铜还原为铜.所以,装置E内观察到的现象是:黑色变成红色;
④实验中两次用到装置A,其目的分别是验证水煤气含有水蒸气,通过验证生成物中有水蒸气来证明水煤气中含有氢气;
故答案为:①H2O、CO2、H2、CO; ②吸收二氧化碳气体,除去水蒸气; ③反应物由黑色变成红色;④验证水煤气含有水蒸气; 通过验证生成物中有水蒸气来证明水煤气中含有氢气.
点评 本题以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCI三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
| A. | Na2CO3 NaCI NaOH | B. | NaOH NaCI Na2CO3 | ||
| C. | NaCI NaOH Na2CO3 | D. | NaCI Na2CO3 NaOH |
15.做完“铁在氧气里燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3).
(2)铁的氧化物均能溶于酸的溶液,如盐酸、硫酸等.
(3)铁能与硫酸铜溶液发生化学反应,但铁的氧化物不能与硫酸铜溶液反应.
(4)铁与酸的溶液反应(如盐酸、硫酸等),有气泡产生.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]Fe3O4和Fe2O3的分解温度、
(1)铁的熔点见上表:(2)Fe2O3高温时分解成Fe3O4.
(3)Fe2O3的颜色为红棕色.
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水.
(2)Fe2O3高温时会分解成Fe3O4和氧气,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3).
(2)铁的氧化物均能溶于酸的溶液,如盐酸、硫酸等.
(3)铁能与硫酸铜溶液发生化学反应,但铁的氧化物不能与硫酸铜溶液反应.
(4)铁与酸的溶液反应(如盐酸、硫酸等),有气泡产生.
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入稀盐酸、硫酸铜等溶液,观察到的现象是冒气泡、生成红色固体等,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]Fe3O4和Fe2O3的分解温度、
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
(3)Fe2O3的颜色为红棕色.
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4.
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须在集气瓶底部放少量的水.
(2)Fe2O3高温时会分解成Fe3O4和氧气,请写出此反应的化学方程式6Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe3O4+O2↑.
12.用贝壳(主要成分是碳酸钙,杂质不参与反应且不溶于水)和纯碱(碳酸钠)为原材料制取烧碱,其制取流程如图:
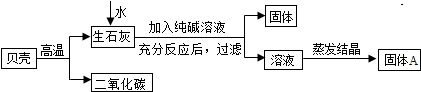
(1)写出加入纯碱溶液后发生反应的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)【问题与发现】固体A是纯净的氢氧化钠吗?
【猜想与假设】根据反应原理,同学们提出以下猜想:
甲的猜想:A是纯净的氢氧化钠固体.乙的猜想:A是氢氧化钠和氢氧化钙的混合物.丙的猜想:氢氧化钠和碳酸钠的混合物.
【实验验证】查阅资料:碳酸钠的水溶液pH>7
【反思与评价】同学们认为甲的结论不一定成立,原因是因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)写出加入纯碱溶液后发生反应的化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(2)【问题与发现】固体A是纯净的氢氧化钠吗?
【猜想与假设】根据反应原理,同学们提出以下猜想:
甲的猜想:A是纯净的氢氧化钠固体.乙的猜想:A是氢氧化钠和氢氧化钙的混合物.丙的猜想:氢氧化钠和碳酸钠的混合物.
【实验验证】查阅资料:碳酸钠的水溶液pH>7
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体A,加适量水溶解,滴加几滴无色酚酞溶液 | 溶液变红 | 猜想甲成立 |
| 乙 | 取少量固体A,加适量水溶解,滴加几滴饱和碳酸钠溶液 | 没有出现白色沉淀 | 猜想乙不成立 |
| 丙 | 取少量固体A,溶于适量水形成溶液后,滴加足量的稀盐酸 | 开始没有气体产生,后来有气泡产生 | 猜想丙成立 |
9.溶液所具有的特征是( )
| A. | 透明的 | B. | 无色的 | C. | 均一稳定的 | D. | 纯净的 |
14.公安干警在缉毒行动中,训练有素的缉毒犬屡建奇功,嗅出毒品.从分子的角度解释是因为( )
| A. | 分子总是在不断运动着 | B. | 分子间有间隙 | ||
| C. | 分子的体积很小 | D. | 分子可分解成原子 |
