题目内容
13.现有一不纯的氧化铜样品16g可能混有氧化铁、氧化镁、木炭粉、氯化钠中的一种或几种,加入200g稀硫酸恰好完全反应,没有固体剩余,生成3.6g水,则下列判断正确的是( )| A. | 原固体样品中肯定含有木炭粉 | |
| B. | 原固体样品中只混有氧化镁 | |
| C. | 恰好完全反应后溶液中水的质量为184克 | |
| D. | 所用的稀硫酸中溶质质量分数为19.6% |
分析 首先根据无固体剩余可推断混合物一定不含木炭粉,然后根据生成的水与硫酸以及氧化物中的氧元素关系式求算出反应的硫酸的质量以及氧化物中氧元素的质量,进而结合化学式判断对应选项.
解答 解:据无固体剩余可推断混合物一定不含木炭粉.所以A错误.
由于生成的水的氢元素来自硫酸,氧元素来自金属氧化物,所以可得关系式
O∽∽∽H2O∽∽∽H2SO4
设氧化物中的氧元素的质量为x,硫酸的质量为y
O∽∽∽H2O∽∽∽H2SO4
16 18 98
x 3.6g y
$\frac{16}{x}$=$\frac{18}{3.6g}$=$\frac{98}{y}$
x=3.2g
y=19.6g
所以用的稀硫酸中溶质质量分数为为$\frac{19.6g}{200g}$×100%=9.8%.所以D错误.
恰好完全反应后溶液中水的质量为200g-19.6g+3.6g=184g.所以C正确.
金属混合物中氧元素的质量分数为$\frac{3.2g}{16g}$×100%=20%
而氧化铜中氧元素的质量分数为$\frac{16}{64+16}$×100%=20%
氧化铁中氧元素的质量分数为$\frac{16×3}{56×2+16×3}$×100%=30%
氧化镁中氧元素的质量分数为$\frac{16}{24+16}$×100%=40%
所以杂质是氧化铁和氯化钠的混合物或者氧化镁和氯化钠的混合物或者是氧化铁、氧化镁和氯化钠的混合物.所以B错误.
故选:C.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
相关题目
10. 下列关于水的电解实验(如图所示)的说法中正确的是( )
下列关于水的电解实验(如图所示)的说法中正确的是( )
 下列关于水的电解实验(如图所示)的说法中正确的是( )
下列关于水的电解实验(如图所示)的说法中正确的是( )| A. | 该实验说明了水是由氢气和氧气组成的 | |
| B. | 该实验说明水是由氢原子和氧原子构成的 | |
| C. | 试管b中的气体是氧气,可用带火星的木条检验 | |
| D. | 实验说明水在通电的条件下,生成了氢气和氧气,其体积比为1:2 |
4.规范的操作是实验成功的保证.下列实验操作正确的是( )
| A. |  铁在氧气中燃烧 | B. |  收集氧气 | C. |  滴加液体 | D. |  测溶液的pH值 |
18.如图是对实验绘制的相关物质变化图形,其中实验结果与图形对应准确的是( )
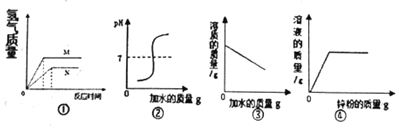

| A. | 图①金属的活泼性M>N | |
| B. | 图②是向硫酸溶液中加水,溶液pH的变化 | |
| C. | 图③是向饱和食盐水中不断加水 | |
| D. | 图④是向一定质量硫酸铜溶液中不断加入锌粉 |
3.关于Fe+2FeCl3═3X反应叙述合理的是( )
| A. | 该反应涉及的物质都是由原子构成的 | |
| B. | FeCl3中铁元素、氯元素的质量比为1:3 | |
| C. | X的化学式为FeCl2 | |
| D. | Fe中铁元素的化合价为+3 |

