题目内容
2.化学与能源密切相关.氢化镁可作氢动力汽车的能源提供剂:MgH2+2X=Mg(OH)2+2H2↑,则X的化学式为H2O.2017年5月,我国成为第一个实现海域开采可燃冰(主要含有甲烷水合物)并连续稳定产气的国家,甲烷充分燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.相等质量的氢气、甲烷完全燃烧需要氧气的质量比为2:1.分析 根据质量守恒定律推断物质的化学式;根据甲烷燃烧生成二氧化碳和水,写出反应的化学方程式即可.根据氢气和氧气反应会生成水,甲烷和氧气反应生成水和二氧化碳,可以假设参加反应的氢气、甲烷的质量是1g,然后依据化学方程式求出需要的氧气的质量,再求出质量比.
解答 解:MgH2+2X=Mg(OH)2+2H2↑,化学反应前后元素的种类和原子的个数不变,反应前含有1个Mg原子,2个H原子,2个X,反应后含有1个Mg原子,2个O原子和6个H原子,故2个X中含有4个H原子和2个氧原子,1个X中含有2个H原子和1个氧原子,故是水,
甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
解:设参加反应的氢气、甲烷和一氧化碳的质量是1g,需要的氧气的质量分别是x,y,z,所以
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O
4 32 16 64
1g x 1g y
$\frac{4}{1g}=\frac{32}{x}$ $\frac{16}{1g}=\frac{64}{y}$
x=8g y=4g
所以需要氧气的质量比是:8g:4g=2:1
故填:H2O; CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O; 2:1.
点评 本题难度不大,掌握质量守恒定律的运用、“可燃冰”的主要成分、化学方程式的书写方法是正确解答本题的关键.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案(1)硫在氧气中燃烧S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(2)铁和硫酸铜溶液反应Fe+CuSO4═FeSO4+Cu.
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
| 生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(2)求恰好完全反应时,溶液中溶质的质量分数.(结果精确到0.1%)

(3)请在图中画出在20g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图.
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由氢氧化钡也会与杂质硫酸钠反应,导致测定结果偏大.
| A. | I2、Br2、Cl2 | B. | Br2、Cl2、I2 | C. | Cl2、I2、Br2 | D. | Cl2、Br2、I2 |
| A. | 回收利用废旧金属,不仅可以节约金属资源,还可以减少对环境的污染 | |
| B. | 金属资源中,只有金、银能以单质形式存在 | |
| C. | 煤是复杂的混合物,主要含有碳、氢元素 | |
| D. | 人们正在利用和开发其他能源有太阳能、核能、风能、水能、地热能和潮汐能、氢能 |
| 选项 | 目的 | 方案 |
| A | 除去炭粉中少量CuO | 在空气中充分灼烧 |
| B | 除去KCl中混有的少量KClO3 | 取样,加二氧化锰,充分加热 |
| C | 鉴别化肥NH4Cl和(NH4)2SO4 | 取样,加热石灰,研磨 |
| D | 除去N2中混有的少量O2 | 通过灼热的铜网 |
| A. | A | B. | B | C. | C | D. | D |
 为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量.某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量.某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示: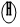 和
和  分别表示氢原子和氧原子,下图是水在通电条件下发生反应的微观模拟图.
分别表示氢原子和氧原子,下图是水在通电条件下发生反应的微观模拟图.