题目内容
19.结合如图所示实验装置回答问题:
(1)仪器①的名称是长颈漏斗.
(2)实验室制取二氧化碳,选用的装置组合是BC(填标号),检验二氧化碳收集满的操作是将燃着的小木条平伸到瓶口,观察木条是否熄灭.
(3)实验室若用高锰酸钾制取氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,可选用的收集装置是CE(填标号).
分析 (1)据常用仪器的名称解答;
(2)根据实验室制取二氧化碳的药品解答,反应装置和收集装置的选择依据反应物的状态、反应条件、气体的水溶性、气体的密度等进行选择;
(3)高锰酸钾制氧气属于固体加热制气体,所以选择A,根据氧气的密度和溶解性选择收集装置,在写化学方程式时一定要注意反应条件.
解答 解:(1)仪器①的名称是长颈漏斗;
(2)实验室用石灰石和稀盐酸来反应制取二氧化碳,二氧化碳溶于水,不能用排水法,密度比空气大,能用向上排空气法,故选用的装置组合是BC;检验二氧化碳收集满的操作是燃着的小木条平伸到瓶口,观察木条是否熄灭;
(3)高锰酸钾制氧气属于固体加热制气体,故答案为A;反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,氧气不溶于水,可以用排水法,又因为密度比空气大,所以也可以向上排空气法.
故答案为:(1)长颈漏斗;
(2)BC、将燃着的小木条平伸到瓶口,观察木条是否熄灭;
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,CE.
点评 要求学生掌握气体的发生装置和收集装置的选择条件,便于灵活运用.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |

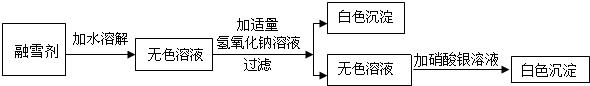
①40℃时,向两个分别盛有45g KNO3和KCl固体的烧杯中,各加入100g的水,充分溶解后,结果如右上图所示,则乙烧杯中的溶质是KNO3.
②欲配制溶质的质量分数为20%的硝酸钾饱和溶液,应满足的温度范围是10℃-20℃.
③用80%的硫酸100g配制10%的硫酸溶液,需要加水多少毫升?
(1)根据如表中提供的信息,填写有关含碳物质的对应性质.
| 物质用途 | 石墨作电极 | 金剛石切割玻璃 | 活性炭净水 |
| 对应性质 | 导电性 | 硬度大 | 吸附性 |
A.液态二氧化碳气化后不会污染档案资料
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物的着火点
(3)天然气的主要成分是甲烷(CH4).写出甲烷在空气中完全燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.过多
排放二氧化碳会引起温室效应.因而人们积极寻找不含碳元素的燃料,普及利用新能源.如太阳能、水能等.
| A. | 碳酸钙粉末 | B. | 生石灰粉末 | C. | 澄清的石灰水 | D. | 铁粉 |
碱式碳酸铜可用于生产木材防腐剂等。工业上常在含有硫酸铜的废水中加入碳酸钠溶液,得到碱式碳酸铜沉淀。
(1)产品生产中加入Na2CO3溶液时,反应液pH对产品中SO42-的含量以及反应液中Cu2+沉淀效率的影响如图所示,沉淀时溶液pH最好控制在_________左右。
(2)实验探究
Ⅰ.验证碱式碳酸铜的分解产物,可选装置如图所示。

甲同学将装置按BCA的顺序组合进行实验,装置A中盛放的试剂的作用是___________,装置C中的现象为___________。装置C、A顺序不能颠倒的原因是___________。
实验结束,B装置中粉末完全变黑。关于黑色物质的成分,有人认为可能有碳,请从物质的物理性质和元素守恒角度说明此猜想的依据是_____________。
乙同学为确认该黑色粉末是氧化铜而不是碳粉,设计如下实验,请完成下表:
实验步骤 | 观察到的现象 | 获得结论 | 反应的化学方程式 |
取少量黑色粉末于试管中,向其中加入足量的稀硫酸,振荡 | _______ | 黑色粉末均为氧化铜 | _______ |
Ⅱ.丙同学探究CO还原CuO所得固体产物的成分,实验装置如下图:

资料:CO还原CuO的实验过程中,固体产物可能有Cu2O(红色固体)、Cu。
反应前 | 反应后 |
玻璃管和内盛氧化铜 粉末的总质量为62.0 g | 玻璃管和内盛红色 粉末的总质量为61.7 g |
玻璃管的质量为60.0 g | |
(1)打开K,缓缓通入CO气体,一段时间后加热。当黑色固体全部变红后停止加热,继续通入CO气体直至玻璃管冷却。
①由实验数据计算可知,CuO中铜元素的质量为_________g,红色固体粉末成分为_________。
②下列有关该实验的说法正确的是_____________。
A.先通入一会CO再加热是为了排净装置中的空气
B.实验结束必须先将玻璃管与虚线框内的装置分开,防止溶液倒吸
C.装置图中虚线框内的装置既能吸收二氧化碳,又能收集一氧化碳
D.排入到烧杯中的溶液可能显碱性,也可能显中性
Ⅲ.工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。为测定某种产品的组成,丁同学设计的实验方案中有如下步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g。请根据实验数据,计算确定该碱式碳酸铜的化学式。写出计算过程。_______
 表示氨原子,●表示氧原子,○表示氢原子).该反应的化学方程式为4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
表示氨原子,●表示氧原子,○表示氢原子).该反应的化学方程式为4NH3+5O2$\frac{\underline{\;一定条件下\;}}{\;}$4NO+6H2O.
