题目内容
10.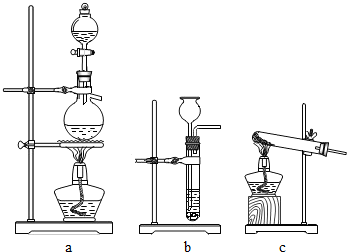 铜粉中常混有少量的氧化铜粉末,现要测量某铜粉样品中铜的质量分数,以下两组同学均取样品l0g进行实验.
铜粉中常混有少量的氧化铜粉末,现要测量某铜粉样品中铜的质量分数,以下两组同学均取样品l0g进行实验.(1)甲组同学准备用还原法还原氧化铜,实验室可用的还原剂
有H2、CO以及炭粉.
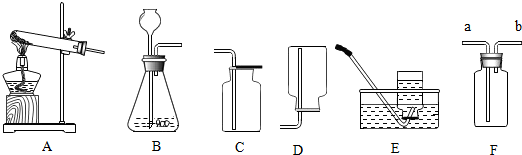
①若要利用CO进行还原,实验室中可用甲酸溶液和浓硫酸加热
反应制得CO,则制取CO气体可用到的仪器装置是图中的
a(选填“a”、“b”或“c”).
②若利用气体进行还原,甲同学考虑使用H2,他认为制取氢气
应该用锌和稀硫酸反应,不宜用铝和稀硫酸作反应物,原因是
锌与稀硫酸反应的速度适中,易于控制;如果用H2还原氧化铜,反应前后样品质量减少了0.08g,
则原样品中铜的质量分数是96%.
③利用碳还原氧化铜,利用吸收液吸收反应产生的CO2,如果反应中只有CO2生成且完全被吸收,吸收液的质量增加a克,则样品中CuO的质量为$\frac{40a}{11}$克.
(2)乙组同学采用与稀硫酸反应的方法.写出样品中加入稀硫酸发生反应的化学方程式CuO+H2SO4═CuSO4+H2O.
分析 (1)①根据反应的原理分析制取装置;②根据金属的活动性分析;化合物中元素的质量=化合物的质量×元素的质量分数;
③氢氧化钠能和二氧化碳反应生成碳酸钠和水;吸收液的质量增加a克,即为生成二氧化碳ag,结合化学方程式求解;
(2)氧化铜和稀硫酸反应能生成硫酸铜和水.
解答 解:
(1)①实验室中制取CO可用甲酸和浓硫酸加热反应制得,则制取CO气体可用到的仪器装置编号是a.故填:a.
②铝的活动性比锌强,与稀硫酸反应的速度较快,不易控制.故填:锌与稀硫酸反应的速度适中,易于控制.
应前后样品质量减少0.08g,说明氧化铜中氧元素的质量是0.08g,根据氧化铜的化学式可知,消耗氧化铜质量为0.08g×$\frac{80}{16}$=0.4g,铜的质量是10g-0.4g=9.6g,铜的质量分数为:$\frac{9.6g}{10g}$×100%=96%.故填:96%.
③设样品中CuO的质量为x
C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,
160 44
x ag
$\frac{160}{x}=\frac{44}{ag}$
x=$\frac{40a}{11}$g
故答案为:$\frac{40a}{11}$;
(2)样品中加入稀硫酸发生的化学方程式为:CuO+H2SO4═CuSO4+H2O.
故答案为:CuO+H2SO4═CuSO4+H2O.
点评 本题主要考查计算、实验操作、化学方程式的书写等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.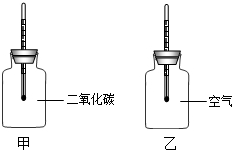 某学校科学兴趣小组想设计一个实验,来模拟研究CO2:浓度增加是否增大地球“温室效应”.他们查阅了有关数据,并设计了下面的实验和操作步骤:
某学校科学兴趣小组想设计一个实验,来模拟研究CO2:浓度增加是否增大地球“温室效应”.他们查阅了有关数据,并设计了下面的实验和操作步骤:
Ⅰ、在两只同样的玻璃瓶里分别充满CO2和空气,并编号为甲、乙,塞紧带有同样温度计的橡皮塞.再把两只玻璃瓶放在阳光下照射(如图),观察甲、乙瓶中的温度变化.
Ⅱ、阳光持续照射,间隔一定时间测量两玻璃瓶温度值,并记录(见表)
请回答下列问题:
(1)写出实验室制取CO2的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)往瓶中充CO2时,验证瓶中已充满了CO2的方法是把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明瓶中充满了二氧化碳.
(3)该实验中,照射同样时间,根据上表的数据,比较甲、乙瓶温度变化的规律是先是甲瓶中温度上升的快,后是两瓶中温度上升速率相同.
(4)该实验中,在阳光照射下,影响甲、乙瓶温度不同的原因,除了CO2的温室效应以外,还有的可能原因是(写出一点即可)两种气体的比热不同
(5)有同学认为根据该模拟实验的目的,实验设计存在问题,你认为是(写出一点即可)该实验没有模拟地球的生态系统.
 某学校科学兴趣小组想设计一个实验,来模拟研究CO2:浓度增加是否增大地球“温室效应”.他们查阅了有关数据,并设计了下面的实验和操作步骤:
某学校科学兴趣小组想设计一个实验,来模拟研究CO2:浓度增加是否增大地球“温室效应”.他们查阅了有关数据,并设计了下面的实验和操作步骤:Ⅰ、在两只同样的玻璃瓶里分别充满CO2和空气,并编号为甲、乙,塞紧带有同样温度计的橡皮塞.再把两只玻璃瓶放在阳光下照射(如图),观察甲、乙瓶中的温度变化.
Ⅱ、阳光持续照射,间隔一定时间测量两玻璃瓶温度值,并记录(见表)
| 时刻 | 9:23 | 9:28 | 9:33 | 9:38 | 9:43 | 9:48 | 9:53 | 9:58 | 10:06 | 10:11 | 10:25 |
| 甲瓶温度/℃ | 13.0 | 19.8 | 23.5 | 26.0 | 26.4 | 27.0 | 27.5 | 27.8 | 28.0 | 28.0 | 28.1 |
| 乙瓶温度/℃ | 13.0 | 19.0 | 22.8 | 25.0 | 26.0 | 26.5 | 27.0 | 27.4 | 27.9 | 28.0 | 28.1 |
(1)写出实验室制取CO2的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)往瓶中充CO2时,验证瓶中已充满了CO2的方法是把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明瓶中充满了二氧化碳.
(3)该实验中,照射同样时间,根据上表的数据,比较甲、乙瓶温度变化的规律是先是甲瓶中温度上升的快,后是两瓶中温度上升速率相同.
(4)该实验中,在阳光照射下,影响甲、乙瓶温度不同的原因,除了CO2的温室效应以外,还有的可能原因是(写出一点即可)两种气体的比热不同
(5)有同学认为根据该模拟实验的目的,实验设计存在问题,你认为是(写出一点即可)该实验没有模拟地球的生态系统.
5.下列实验操作和现象中,能证明氢氧化钠溶液与稀硫酸发生了反应的是( )
| A. | 向一定量的氢氧化钠溶液中滴加稀硫酸后,再滴加硫酸铜溶液,有蓝色沉淀生成 | |
| B. | 向一定量的氢氧化钠溶液中滴加稀硫酸后,再滴加氯化钡溶液,有白色沉淀生成 | |
| C. | 向一定量的稀硫酸中加入氢氧化钠固体后,液体的温度明显上升 | |
| D. | 向一定量的稀硫酸中滴加氢氧化钠溶液,振荡后再滴加碳酸钠溶液,无气泡生成 |
19.下列图示的实验操作正确的是( )
| A. |  读液体的体积 | B. |  熄灭酒精灯 | C. |  称量固体 | D. |  倾倒液体 |

 A、B、C、D各为初中化学常见的氧化物、酸、碱、盐中的一种物质.它们相互转化关系如图(图中“→”表示物质间存在转化关系,“-”表示物质间能发生化学反应).A、B、D中都含有生物细胞中含量(质量分数)居第二位的元素;B是一种常用于灭火的气体;D广泛用于玻璃、造纸、纺织和洗涤剂的生产.
A、B、C、D各为初中化学常见的氧化物、酸、碱、盐中的一种物质.它们相互转化关系如图(图中“→”表示物质间存在转化关系,“-”表示物质间能发生化学反应).A、B、D中都含有生物细胞中含量(质量分数)居第二位的元素;B是一种常用于灭火的气体;D广泛用于玻璃、造纸、纺织和洗涤剂的生产.