题目内容
2. 学习酸碱中和反应时,很多同学对实验产生了探究兴趣.
学习酸碱中和反应时,很多同学对实验产生了探究兴趣.(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论.乙同学认为甲同学推理不合理,理由是:固体氢氧化钠溶于水放热;
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图:由图知,稀硫酸与氢氧化钠溶液发生的反应是放热(填“放热”或“吸热”)反应,B点表示的含义是酸碱恰好完全中和;
(3)丙同学将稀硫酸滴入氢氧化钠溶液中,有气泡产生,他认为氢氧化钠溶液已变质.请你分析变质的原因(用化学方程式表示)2NaOH+CO2═Na2CO3+H2O.
分析 (1)甲同学的操作包括了氢氧化钠固体的溶解过程和与硫酸反应的过程,不能就说是中和反应放热,
(2)根据图象可以看出随着硫酸的加入温度在逐渐的上升,B点在温度上是个转折点,在反应也是个转折点;
(3)根据氢氧化钠变质的原因来分析.
解答 解:(1)在甲同学的操作过程中既有氢氧化钠固体的溶解过程,也有和硫酸中和的过程,不能认为就是中和反应放热.
故答案为:固体氢氧化钠溶于水放热;
(2)根据图象可以看出随着硫酸的加入,温度在逐渐的升高.
故答案为:放热;
既然是硫酸中和氢氧化钠的反应是放热,随着反应的进行放出的热量不断变多温度也不断升高,因此恰好反应时温度最高即为B点.
故答案为:酸碱恰好完全中和;
(3)氢氧化钠在空气中变质后生成的碳酸钠和硫酸的反应,生成物为硫酸钠、水和二氧化碳.
故答案为:2NaOH+CO2═Na2CO3+H2O.
点评 本题主要考查了结合图象对中和反应的更深层次的理解,难度较大,知识面广.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
10.有一天,某学习小组野炊活动,所带的物品如下表:
(1)在讨论中餐食谱时,他们发现所带食物不符合平衡膳食的要求,因为食物中缺少了水果、蔬菜.
(2)野炊活动中,有一同学被蜜蜂意外蛰伤,蜜蜂毒液呈酸性.其他同学马上利用肥皂水为其涂抹患处,结果症状大大减轻,这是因为肥皂水呈碱性.
(3)野炊回来后,小科从资料中获悉:某品牌酱油每100mL中铁营养剂的标准添加量是0.2g,铁营养剂中铁元素质量分数为12.5%.由此可计算一瓶448mL该品牌中所含的铁相当于多少克硫酸亚铁中所含的铁元素质量?
| 食物 | 大米、猪排骨、猪肝、鸡肉、鸡蛋、豆腐 |
| 调料 | 食盐、碱面、蔗糖、食醋、味精、酱油、食用油 |
| 用品 | 铁锅、铁铲、碗、筷子、肥皂 |
(2)野炊活动中,有一同学被蜜蜂意外蛰伤,蜜蜂毒液呈酸性.其他同学马上利用肥皂水为其涂抹患处,结果症状大大减轻,这是因为肥皂水呈碱性.
(3)野炊回来后,小科从资料中获悉:某品牌酱油每100mL中铁营养剂的标准添加量是0.2g,铁营养剂中铁元素质量分数为12.5%.由此可计算一瓶448mL该品牌中所含的铁相当于多少克硫酸亚铁中所含的铁元素质量?
17.把金属X放入CuSO4溶液中,X表面有红色固体析出;若放入FeSO4溶液中,无明显现象. 则X、Cu、Fe三种金属活动性由强到弱的顺序正确的是( )
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
14.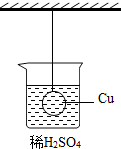 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
 如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
11.一个碳原子的质量为b千克,其相对原子质量为12;一个氧原子的质量为a千克,则该氧原子的相对原子质量为( )
| A. | 16 | B. | $\frac{b}{12a}$ | C. | $\frac{a}{12b}$ | D. | $\frac{12a}{b}$ |
 初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.
初中几种常见物质间的反应及转化关系如图所示,物质B是一种红色固体粉末,该图体现了化合物F的四种不同化学性质,请依据此图完成下列问题.