题目内容
6. 为测定由氯化钙和氯化钠组成的固体样品中氯化钙的含量,某同学进行了如下实验:取20g固体样品,全部溶于100g水中,向所得的混合溶液中滴加碳酸钠溶液,记录并绘制了如图所示的曲线.
为测定由氯化钙和氯化钠组成的固体样品中氯化钙的含量,某同学进行了如下实验:取20g固体样品,全部溶于100g水中,向所得的混合溶液中滴加碳酸钠溶液,记录并绘制了如图所示的曲线.(1)当氯化钙与碳酸钠恰好反应时,所提沉淀的质量为10克.
(2)计算样品中氯化钙的质量分数.(CaCI2+Na2CO3═2NaCI+CaCO3↓)
(3)当加入碳酸钠溶液质量为100克时,所得到溶液中的溶质有NaCl、Na2CO3.
分析 (1)根据图象看得到沉淀的质量,根据氯化钠的溶解度考虑结晶方法;
(2)根据沉淀质量计算出氯化钙的质量,再除以14g就行;
(3)根据图示,找出在何时反应已完全,即可得知当氯化钙与碳酸钠恰好完全反应时,消耗碳酸钠溶液的质量;由此判断所加入碳酸钠溶液有剩余.
解答 解:(1)由图示可知到了10g沉淀不再增加,说明反应完最多生成10g沉淀;如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于氯化钠的溶解度受温度影响较小,所以用蒸发溶剂方法,先将沉淀过滤除去再蒸发;
(2)解:设样品中氯化钙的质量为x,
CaCl2+Na2C03=CaC03↓+2NaCl
111 100
x 10g
根据$\frac{111}{100}=\frac{x}{10g}$
解得x=11.1g
答:样品中氯化钙的质量分数为$\frac{11.1g}{20g}$×100%=55.55%.
(3)根据图示,当加入100g碳酸钠溶液时恰好完全反应,因此当加入100克碳酸钠溶液时碳酸钠过量,所得溶液为混合溶液,其中溶质是NaCl和Na2CO3.
故答案为:
(1)10;
(2)55.55%
(3)NaCl、Na2CO3
点评 主要考查学生对完全反应的认识,以及运用化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
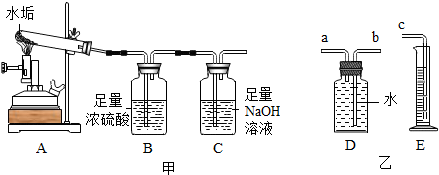
16.在没有现成的CO2气体发生器的情况下,请你选用如图中的部分仪器,装配成一个简易的、能随用随停的CO2气体发生器,应选用的仪器是( )


| A. | a b c d | B. | a b d f | C. | a c d e | D. | a b c e |
1.青铜是铜锡合金.我国古代金属锡的冶炼发生的反应主要是:SnO2+2C$\frac{\underline{\;高温\;}}{\;}$Sn+2CO↑,该反应类型属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
11.下图所示实验装置或实验操作正确的是( )
| A. |  除去CO中少量的CO2 | B. |  检查装置的气密性 | ||
| C. |  加热蒸发NaCl溶液 | D. |  稀释浓H2SO4 |
15.小明买了一种“汽泡爽”的冲调饮料(如图1).

(1)小明阅读资料发现:“汽泡爽”原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,请填写柠檬酸的化学式.3NaHCO3+C6H8O7═C6H5O7Na3+3H2O+3CO2↑
(2)小明想探究加水温度对产生气体量的影响,小明设计了如下实验方案.
在老师的帮助下,小明采用相同的两套实验装置(如图2)分别完成上述实验,在A中加入水,再加入一袋“汽泡爽”,迅速塞紧胶塞.量筒C用于收集A中产生的气体所排出的液体,冷却至室温后读取数据.B中油层的作用是防止二氧化碳溶于水.
(3)通过实验,小明测得:a=64mL,b=132mL,由此获得结论:“汽泡爽”产生气体的量与加水温度有关系.但是老师看到小明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是反应物的量不变生成物的量也不变.
(4)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是不断摇动两套装置中的锥形瓶A,继续收集气体并测量体积.

(1)小明阅读资料发现:“汽泡爽”原料中的柠檬酸和小苏打(NaHCO3)粉末混合后加水,可以发生以下反应,请填写柠檬酸的化学式.3NaHCO3+C6H8O7═C6H5O7Na3+3H2O+3CO2↑
(2)小明想探究加水温度对产生气体量的影响,小明设计了如下实验方案.
| 实验序号 | 加入水的体积 | 加入水的温度 | 收集到的气体的体积 |
| 1 | 200mL | 15℃ | a(待记录) |
| 2 | 200mL | 50℃ | b(待记录) |
(3)通过实验,小明测得:a=64mL,b=132mL,由此获得结论:“汽泡爽”产生气体的量与加水温度有关系.但是老师看到小明的实验报告后却指出:两套装置中,“汽泡爽”产生气体的总量应该近似相等,与温度关系不大,其本质原因是反应物的量不变生成物的量也不变.
(4)通过反思,为了证明老师的观点,小明继续利用(3)中已反应完的两套装置,又做了一步实验,发现两套装置最终收集到的气体的总量确实相近,他的实验操作是不断摇动两套装置中的锥形瓶A,继续收集气体并测量体积.
 据悉,我国长征7号火箭可能在2016年进行首次发射,该型火箭采用了无毒、无污染的液氢、煤油燃料,并采用模块化设计,可以用多种型号的发动机和助推器组合成适应不同航天器的发射工具.长征7号火箭将是未来20年内世界上性能价格比最高的运载火箭之一.请回答下列问题:
据悉,我国长征7号火箭可能在2016年进行首次发射,该型火箭采用了无毒、无污染的液氢、煤油燃料,并采用模块化设计,可以用多种型号的发动机和助推器组合成适应不同航天器的发射工具.长征7号火箭将是未来20年内世界上性能价格比最高的运载火箭之一.请回答下列问题: