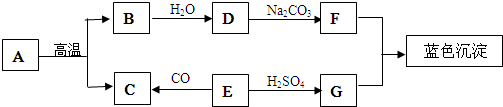
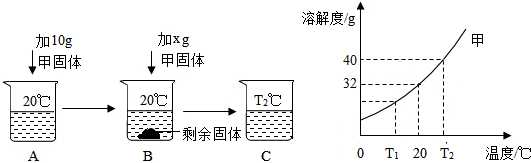
题目内容
20.将m1g碳与m2g氧气置于密闭容器中,在一定条件下充分反应,恢复至常温,若此时密闭容器中的气体是纯净物,则m1:m2不可能是( )| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 3:8 |
分析 根据碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳解答;
解答 解:
碳燃烧的化学方程式为C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2
12 32
2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO
24 56
由化学方程式及其质量关系可知,质量比为1:1的碳和氧气反应后,碳过量,碳又和生成的二氧化碳反应生成一氧化碳,充分反应后恢复到常温,密闭容器中的气态物质是二氧化碳和一氧化碳,为混合物;
质量比为1:2的碳和氧气反应后,碳过量,碳又和生成的二氧化碳反应生成一氧化碳,充分反应后恢复到常温,密闭容器中的气态物质是二氧化碳和一氧化碳,为混合物;
质量比为3:4的碳和氧气反应后,碳和氧气恰好完全反应生成的二氧化碳,密闭容器中的气态物质是二氧化碳,为纯净物;
质量比为3:8的碳和氧气反应后,碳和氧气恰好完全反应生成的一氧化碳,密闭容器中的气态物质是一氧化碳,为纯净物;
答案:AB
点评 本题涉及过量问题,比较难,要注意物质之间反应时,不一定恰好完全反应.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
10.下列关于相应微粒的描述中,不正确的是( )
| A. |  化学性质稳定 | B. |  易形成阴离子 | C. |  带正电荷 | D. |  易失电子 |
11.下列有关推理的说法中正确的是( )
| A. | 蜡烛燃烧生成CO2和H2O,则蜡烛组成里一定含有碳和氢元素 | |
| B. | 氧化物含有氧元素,则含氧元素的化合物都是氧化物 | |
| C. | 碱溶液呈碱性,则呈碱性的溶液一定都是碱溶液 | |
| D. | 使用石油、煤和天然气会排放大量二氧化碳,因此要禁止开发化石能源 |
8. 请完成下列相关内容:
请完成下列相关内容:
Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的.
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为Fe2O3•ⅹH2O(或Fe2O3);铁在氧气中能剧烈燃
烧,现象为剧烈燃烧,火星四射,有黑色固体生成,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的水和二氧化碳有关.
(3)铝在空气中具有很好的抗腐蚀性能,其原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分.
【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【实验探究】
【得出结论】同学们经过实验和计算分析,该固体样品中所含物质有Na2O2、NaOH和Na2CO3.
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂.若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程).
 请完成下列相关内容:
请完成下列相关内容:Ⅰ.实验表明,大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的.
(1)铁在潮湿的空气中易生锈,铁锈的主要成分为Fe2O3•ⅹH2O(或Fe2O3);铁在氧气中能剧烈燃
烧,现象为剧烈燃烧,火星四射,有黑色固体生成,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
(2)铜在潮湿的空气中也容易锈蚀生成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3],铜锈蚀除了与氧气有关外,还与空气中的水和二氧化碳有关.
(3)铝在空气中具有很好的抗腐蚀性能,其原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
Ⅱ.过氧化钠(Na2O2)是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分.
【提出问题】变质的过氧化钠粉末中有哪些成分?
【查阅资料】2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2CO2═2Na2CO3+O2
【猜想与假设】(1)粉末成分是Na2O2和NaOH的混合物
(2)粉末成分是Na2O2和Na2CO3的混合物
(3)粉末成分是Na2O2、NaOH 和Na2CO3的混合物
…
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取3.00g变质粉末于一支大试管中,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解, 带火星的木条复燃 | 该固体样品中含有Na2O2,其质量为1.56g. |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀 | 化学方程式Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. | / | / |
【拓展应用】过氧化钠(Na2O2)是供氧设备中常用的供氧剂.若将15.6g过氧化钠与足量的二氧化碳充分反应,理论上生成的氧气质量是多少?(写出计算过程).
15.下列实验设计不能达到实验目的是( )
| A. | 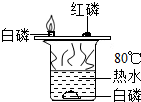 验证可燃物燃烧的条件 | |
| B. | 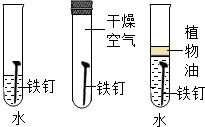 探究铁生锈的条件 | |
| C. | 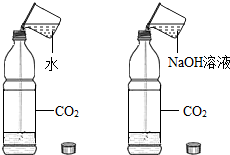 证明CO2和NaOH反应 | |
| D. | 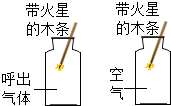 探究呼出气体和空气中氧气含量的不同 |