题目内容
2.水是重要的溶剂,在实验室中常用于溶解物质、配制溶液,在50mL水(密度为1g/mL)中溶解一定量甲固体的操作如下,请根据如图实验现象和溶解度曲线回答.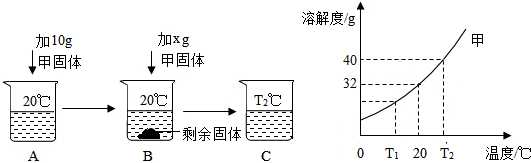
(1)A、B、C中一定是饱和溶液的是B;一定是不饱和溶液的是A(填字母序号);
(2)若x=10g,要使B恰好变成20℃的饱和溶液,需要加水的质量是12.5g;
(3)若C是T2℃的饱和溶液,当降温至20℃时,能析出的固体质量是4g.
分析 根据已有的知识进行分析,在一定温度下,在一定量的溶剂里不能再溶解某种固体的溶液,叫做这种溶质在这种溶剂里的饱和溶液,还能溶解的叫不饱和溶液,据此解答;
解答 解:(1)据图可以看出,B中有剩余的固体,故B一定是饱和溶液;A中加入5g硝酸钾形成的溶液继续加入硝酸钾还能继续溶解,说明A是不饱和溶液;B升高温度后得到的C溶液可能饱和也可能不饱和;
(2)在20℃时,甲的溶解度是32g,则20℃时20g甲物质最少需水的质量是$\frac{100g}{32g}×20g$=62.5g,故x=10g,要使B恰好变成20℃的饱和溶液,需要加水的质量是62.5g-50g=12.5g;
(3)T2℃时甲的溶解度为40g;故50g水中最多溶解甲为20g,20℃时,甲的溶解度为32g;故50g水中最多溶解甲为16g,若C是T2℃的饱和溶液,当降温至20℃时,能析出的固体质量是,20g-16g=4g;
故答案为:
(1)B;A; (2)12.5;(3)4;
点评 本题考查了饱和溶液的有关知识,以及根据溶解度的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
20.将m1g碳与m2g氧气置于密闭容器中,在一定条件下充分反应,恢复至常温,若此时密闭容器中的气体是纯净物,则m1:m2不可能是( )
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 3:8 |
17.有三瓶无色、无味的气体x、y、z,它们分别是甲烷、氢气、一氧化碳中的一种,分别点燃三种气体,用干燥的冷烧杯罩在火焰上方,只有y和z只火焰上方的烧杯内壁有水滴出现,燃烧后分别向烧杯中注入澄清的石灰水,振荡,只有x和y的烧杯内石灰水变浑浊.则x、y、z分别是( )
| A. | CO CH4 H2 | B. | CH4 CO H2 | C. | CH4 H2 CO | D. | H2 CH4 CO |
7. 暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置如图),以下对此改进实验的叙述,错误的是( )
暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置如图),以下对此改进实验的叙述,错误的是( )
 暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置如图),以下对此改进实验的叙述,错误的是( )
暖宝宝中的发热剂是铁粉、水和食盐等,发热剂能代替红磷测定空气中氧气含量(装置如图),以下对此改进实验的叙述,错误的是( )| A. | 此实验的原理是利用铁生锈消耗氧气 | |
| B. | 实验前一定要检查装置的气密性 | |
| C. | 此实验中发热剂应该是足量的 | |
| D. | 此实验测出氧气的体积分数偏大 |
14.研究小组进行木炭还原氧化铁的探究活动,用图1所示的装置加热木炭、氧化铁的混合物(试管竖直向上,可使加热时的热量尽少散失).

【提出问题】实验结束后,试管中的剩余固体X含有那些成分?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.
铁的氧化物及其部分性质如下:
Fe3O4和FeO均为黑色固体.其中,Fe3O4能被磁铁吸引.
Fe3O4与稀盐酸的反应生成氯化铁、氯化亚铁和水,写出该反应的化学方程式:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O.
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3; FeCl3液遇单质铁发生反应:2FeCl3+Fe=3FeCl2.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3⑤C
【实施实验】目的:确定固体X的组成.
【反思】为确定固体X中是否有Fe3O4 ,小明向步骤Ⅳ所得溶液中加入KSCN溶液,溶液不变红色,小明认为固体X中一定没有Fe3O4 .小明的结论是否可靠?简述判断理由.

【提出问题】实验结束后,试管中的剩余固体X含有那些成分?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁.
铁的氧化物及其部分性质如下:
Fe3O4和FeO均为黑色固体.其中,Fe3O4能被磁铁吸引.
Fe3O4与稀盐酸的反应生成氯化铁、氯化亚铁和水,写出该反应的化学方程式:Fe3O4+8HCl═2FeCl3+FeCl2+4H2O.
黄色的FeCl3溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验FeCl3; FeCl3液遇单质铁发生反应:2FeCl3+Fe=3FeCl2.
【猜想】固体X可能含有:①Fe ②FeO ③Fe3O4 ④Fe2O3⑤C
【实施实验】目的:确定固体X的组成.
| 步骤 | 操作 | 主要现象 | 结论 |
| Ⅰ | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引 | 部分固体被吸引 到磁铁上 | 可能有Fe或Fe3O4 |
| Ⅱ | 取滤纸上的剩余固体少量,放入图2所示的 试管a中,通入氧气,用酒精灯加热. | 固体剧烈燃烧,b中溶液变浑浊 | 一定有C |
| Ⅲ | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸. | 无明显现象 | FeO和Fe2O3 |
| Ⅳ | 取步骤 I 磁铁上的固体少量,放入试管中,逐滴加入稀盐酸. | 产生气泡 | 一定有Fe |
 如图1是氯化钠和硝酸钾两种固体物质的溶解度曲线
如图1是氯化钠和硝酸钾两种固体物质的溶解度曲线
