题目内容
18.下列说法中,正确的是( )| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
分析 A、根据碳具有还原性,进行分析判断.
B、根据木炭具有可燃性,进行分析判断.
C、根据活性炭具有吸附性,能吸附异味和色素等,进行分析判断.
D、根据金刚石、石墨都是碳元素形成的单质,结合它们的物理性质进行分析判断.
解答 解:A、单质碳具有还原性,故选项说法正确.
B、木炭具有可燃性,燃烧时放出大量的热,故想说法错误.
C、活性炭具有吸附性,能吸附异味和色素等,但不能除去硬水中的氯化钙杂质,故选项说法错误.
D、金刚石、石墨都是由碳原子构成的,但石墨很软,故选项说法错误.
故选:A.
点评 本题难度不大,掌握碳单质的物理性质、化学性质(具有可燃性、还原性)等并能灵活运用是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6. 某陨石中含有如图所示的四种元素,该陨石中可能含有的物质是( )
某陨石中含有如图所示的四种元素,该陨石中可能含有的物质是( )
 某陨石中含有如图所示的四种元素,该陨石中可能含有的物质是( )
某陨石中含有如图所示的四种元素,该陨石中可能含有的物质是( )| A. | CaCl2 | B. | SiO2 | C. | CaCO3 | D. | Fe2O3 |
3.下列实验操作中,正确的是( )
| A. | 用酒精灯的内焰给试管加热 | |
| B. | 向燃着的酒精灯内添加酒精 | |
| C. | 用量筒代替试管作反应容器 | |
| D. | 称量药品时,砝码放在托盘天平的右盘 |
7.废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如图所示:
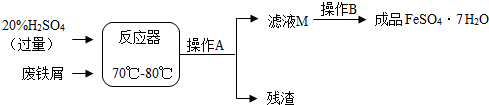
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe═3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
根据溶解度表,要得到纯净的硫酸亚铁晶体(FeSO4•7H2O),冷却结晶温度应该低于
64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.

(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe═3FeSO4外,写出发生的其他一个化学反应方程式:Fe+H2SO4=FeSO4+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)在实验室中操作A是过滤;
(3)滤液M经过操作B可得硫酸亚铁晶体(FeSO4•7H2O).已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
64℃;待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次.用冰水洗涤的目的是:
Ⅰ除去晶体表面附着的杂质;Ⅱ减少晶体溶解,提高产率.
(4)在化学反应中,将有元素化合价变化的反应定义为氧化还原反应.在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它氧化物,试写出该氧化还原反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3.


