题目内容
8.生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,科学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完 全反应(假设杂质不参与反应).测得的实验数据如下:| 反应前 | 反应后 | |
| 烧杯及其中物质的质量 | 97.0g | 96.8g |
(1)生铁样品中铁的质量分数是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
分析 (1)根据铁与硫酸反应放出氢气的特点,根据质量守恒定律,可判断反应前后质量差为恰好完全反应时所产生的氢气质量;根据反应的化学方程式,由恰好完全反应时生成氢气的质量计算所消耗铁的质量;铁的质量与样品的质量比可计算生铁样品的质量分数;
(2)恰好完全反应后所得溶液为硫酸化亚铁溶液,根据反应的化学方程式,由氢气质量计算出生成的硫酸亚铁的质量,利用质量守恒定律计算出恰好完全反应后所得溶液质量,然后利用溶液中溶质质量分数计算公式求出反应后所得溶液中溶质的质量分数.
解答 解:(1)根据质量守恒定律,反应生成的氢气质量=97.0g-96.8g=0.2g;
设生铁中铁的质量为x,生成硫酸亚铁质量为y,则
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.2g
$\frac{56}{x}=\frac{152}{y}=\frac{2}{0.2g}$
x=5.6g,y=15.2g
生铁样品中铁的质量分数=$\frac{5.6g}{6.0g}$×100%=93.3%
(2)反应后所得溶液中溶质的质量分=$\frac{15.2g}{65.0g+5.6g-0.2g}$×100%≈21.6%
答:(1)生铁中铁的质量分数为93.3%,
(2)反应所得溶液中FeSO4的质量分数约为21.6%.
点评 根据质量守恒定律,反应后所得溶液质量=参加反应铁的质量+所加入的稀硫酸的质量-反应放出氢气的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列实验或操作中:①溶解 ②过滤 ③蒸发 ④用pH试纸测定溶液的酸碱性 ⑤配制一定溶质质量分数的溶液,均要用到的仪器是( )
| A. | 烧杯 | B. | 玻璃棒 | C. | 漏斗 | D. | 胶头滴管 |
16.现有铜与另一种金属的混合物粉末,另一种金属可能是铝、铁、锌中的一种,现欲测定其组成.取该混合物粉末8.0g放入烧杯中,将140.0g14.0%的稀硫酸分四次加入到该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:
通过计算(写出计算过程,结果精确到0.1%),求:
(1)该混合物粉末中另一金属为何种金属?
(2)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
| 实验次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/克 | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/克 | 7.1 | 6.2 | 5.3 | 5.1 |
(1)该混合物粉末中另一金属为何种金属?
(2)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
3.20℃时氯化钠在水中的溶解度是36g.在该温度下,50g水中放入20g氯化钠,溶解后所得溶液中氯化钠的质量分数为( )
| A. | 26.5% | B. | 28.6% | C. | 40% | D. | 30% |
13.“舌尖上的中国”的热播让厨房成为人们施展厨艺的舞台,其实厨房也是同学们的家庭实验室,下列实验中无法利用厨房物品完成的是( )
| A. | 探究铁制品在什么条件下容易生锈 | B. | 鉴别纯碱和食盐 | ||
| C. | 检验味精中氯化钠的含量 | D. | 比较食盐、蔗糖在水中的溶解能力 |
20.采取正确的措施,能够避免火灾发生或减少火灾损失.下列灭火方法不恰当的是( )
| A. | 油锅起火--用锅盖盖灭 | B. | 酒精灯着火-用湿抹布盖灭 | ||
| C. | 森林起火--砍伐树木形成隔离带 | D. | 汽车油箱着火-用水浇灭 |
17.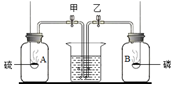 如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )
如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )
 如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )
如图,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,你将看到的现象( )| A. | A瓶中有水流入 | B. | A、B瓶中均无水流入 | ||
| C. | A、B瓶中均有水流入 | D. | B瓶中有水流入 |
18.在物质状态的变化中,伴随分子之间的间隔的变化,同时发生变化的是( )
| A. | 分子数量 | B. | 分子大小 | C. | 分子种类 | D. | 分子能量 |