题目内容
4.铝、铁、铜是人类广泛使用的三种金属,与我们的生活息息相关.(1)铝具有良好的抗腐蚀性能的原因是铝能在表面形成致密的氧化铝薄膜,从而阻止内部的铝进一步氧化.
(2)铁制品在空气中易生锈,铁锈的主要成分是氯化铁,写出盐酸和铁锈的化学方程式Fe2O3+6HCl═2FeCl3+3H2O,该反应的基本反应类型是复分解反应.
(3)将铁粉加入到硝酸铝和硝酸铜的混合溶液中,充分反应后过滤,向滤液中加入稀硫酸有气泡产生、则滤液中含有的溶质有Al(NO3)3、Fe(NO3)2(填化学式),写出滤渣中物质与稀硫酸反应的化学方程式Fe+H2SO4═FeSO4+H2↑.
分析 (1)依据铝会与空气中的氧气反应而形成致密的保护膜,写出相应的方程式;
(2)书写化学方程式要注意规范性.
(3)充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生,此现象说明Fe过量没有反应完,所以原混合溶液中的Cu(NO3)2全部被置换生成Cu和Fe(NO3)2溶液.
解答 解:(1)铝会与空气中氧气反应形成致密的保护膜,阻止铝继续被腐蚀,所以在空气中铝更耐腐蚀,
故方程式为:4Al+3O2=2Al2O3;
(2)盐酸和铁锈的主要成分氧化铁反应能生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.该反应为复分解反应;
(3)合溶液中的和硝酸铜与铁发生置换反应,而硝酸铝不与铁反应,故得到Cu,铁粉过量,所以滤出固体中含Fe、Cu;反应后的溶液中即滤液不再含的Cu(NO3)2,而是含有生成的Al(NO3)3、Fe(NO3)2;滤渣中物质铁与稀硫酸反应的化学方程式为 Fe+H2SO4═FeSO4+H2↑.
故答案为:
(1)铝能在表面形成致密的氧化铝薄膜,从而阻止内部的铝进一步氧化.
(2)Fe2O3+6HCl═2FeCl3+3H2O,复分解反应.
(3)Al(NO3)3、Fe(NO3)2,Fe+H2SO4═FeSO4+H2↑.
点评 本题很好的考查了金属活动性顺序,让学生自己设计实验并且限制物质的种类,难度较大;此种题型的设计可以利用金属和酸、金属和盐溶液的角度考虑.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.如表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 通过足量氢氧化钠溶液,干燥 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | NaCl溶液 | Na2CO3 | 加入适量CaCl2溶液,过滤 |
| D | Cu(NO3)2溶液 | AgNO3 | 加入适量的稀盐酸,过滤 |
| A. | A | B. | B | C. | C | D. | D |
15.下列做法符合操作规范的是( )
| A. | 过滤时,为加快过滤的速度,可用玻璃搅动漏斗里的液体 | |
| B. | 为了节约药品,可将实验用剩的药品倒回原试剂瓶中 | |
| C. | 给试管里的液体加热时,液体量可占试管容积的$\frac{1}{3}$-$\frac{2}{3}$ | |
| D. | 称量时,用镊子取放砝码 |
12.下列图象能正确反映其对应的实验操作的是( )
| A. |  将锌片插入盛有一定量稀硫酸的烧杯中 | |
| B. |  向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| C. |  电解水 | |
| D. |  向盛有一定量稀盐酸的烧杯中不断滴入NaOH溶液至过量 |
9.下列过程中没有发生化学变化的是( )
| A. |  用石灰石炼铁 | B. |  液氮用于超导技术 | ||
| C. |  用硫酸制火药 | D. |  二氧化碳参与光合作用 |
16.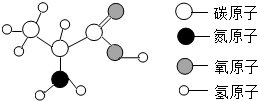 蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
 蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )
蛋白质是由多种氨基酸构成的极为复杂的化合物,相对分子质量从几万到几百万.如图为丙氨酸分子结构模型,下列关于丙氨酸的说法正确的是( )| A. | 它是由四种元素组成的有机高分子化合物 | |
| B. | 每个丙氨酸分子中含有13个原子核 | |
| C. | 丙氨酸分子中含有3个碳原子 | |
| D. | 丙氨酸分子中氮、氧元素的质量比为1:2 |
13. 维生素C又称抗坏血酸,化学式为C6H8O6,对提高人体免疫力有很大帮助.下列关于维生素C的说法中正确的是( )
维生素C又称抗坏血酸,化学式为C6H8O6,对提高人体免疫力有很大帮助.下列关于维生素C的说法中正确的是( )
 维生素C又称抗坏血酸,化学式为C6H8O6,对提高人体免疫力有很大帮助.下列关于维生素C的说法中正确的是( )
维生素C又称抗坏血酸,化学式为C6H8O6,对提高人体免疫力有很大帮助.下列关于维生素C的说法中正确的是( )| A. | 一个维生素C分子中含有176个质子 | B. | 维生素C出碳、氢、氧三种原子构成 | ||
| C. | 维生素C是一种有机化合物 | D. | 维生素C中碳元素的质量分数最大 |
 如图中A、B、C、D都是初三化学学习中常见的物质,其反应关系如图所示(“→”表示转化关系,“-”表示反应关系,反应条件及其他产物略写),其中A,D是日常生活中最常见的金属,A是人类使用最广泛的金属,B是A的金属氧化物且称棕红色,D是电线电缆中常用的导电材料
如图中A、B、C、D都是初三化学学习中常见的物质,其反应关系如图所示(“→”表示转化关系,“-”表示反应关系,反应条件及其他产物略写),其中A,D是日常生活中最常见的金属,A是人类使用最广泛的金属,B是A的金属氧化物且称棕红色,D是电线电缆中常用的导电材料