题目内容
14.将一定量的NaCl和Na2SO4固体混合物完全溶于水后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到23.3g沉淀,经测定滤液中含氯元素的质量为21.3g(不考虑过滤过程中物质质量的损失).计算:(1)所加BaCl2溶液的溶质质量分数.
(2)原固体混合物中Na2SO4的质量.
(3)原固体混合物中NaCl的质量.
分析 硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)设氯化钡质量为x,硫酸钠质量为y,
BaCl2+Na2SO4═BaSO4↓+2NaCl,
208 142 233
x y 23.3g
$\frac{208}{x}$=$\frac{142}{y}$=$\frac{233}{23.3g}$,
x=20.8g,y=14.2g,
所加BaCl2溶液的溶质质量分数为:$\frac{20.8g}{208g}$×100%=10%,
答:所加BaCl2溶液的溶质质量分数为10%.
(2)答:原固体混合物中Na2SO4的质量是14.2g.
(3)氯化钡中氯元素质量为:20.8g×$\frac{71}{208}$×100%=7.1g,
原固体混合物中NaCl中的氯元素质量为:21.3g-7.1g=14.2g,
原固体混合物中NaCl的质量为:14.2g÷($\frac{35.5}{58.5}$×100%)=23.4g,
答:原固体混合物中NaCl的质量为23.4g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.小刘同学需配制100g10%的氢氧化钠溶液,在配制溶液过程中下列说法正确的是( )
| A. | 在托盘上垫上纸并称取10g氢氧化钠固体 | |
| B. | 用100mL量筒量取90mL水 | |
| C. | 称量时发现指针向右偏转,应调节游码使天平平衡 | |
| D. | 把称取氢氧化钠固体直接倒入装有90mL水的量筒中溶解 |
2.飞机是人们生活中经常使用到的交通工具,它的结构复杂,所用到的材料也是范围广泛.如飞机上的合金材料主要有铝合金、镁合金、钛合金和镍钼钨合金等.这些合金材料中的铝、镁、钛等元素的本质区别是( )
| A. | 元素符号不同 | B. | 质子数不同 | ||
| C. | 核外电子数不同 | D. | 相对原子质量不同 |
9.有一包固体粉末,可能含有FeCl3、CuSO4、BaCl2、Na2SO4中的一种或几种,为鉴别它们做如下实验:取少量该固体粉末溶于适量的水中,得到蓝色溶液,那么在此固体粉末中肯定有的物质是( )
| A. | FeCl3、BaCl2 | B. | CuSO4、Na2SO4 | C. | CuSO4、BaCl2 | D. | FeCl3、CuSO4 |
19.实验室在清理实验药品时,发现两瓶失去标签的无色溶液,只知道它们是Na2CO3溶液和KOH溶液,试用两种化学方法将它们鉴别出来,请分别写出鉴别所用试剂的化学式:
(1)HCl;(2)Ca(OH)2.
(1)HCl;(2)Ca(OH)2.
6.如图是四位同学的讨论,其中错误的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
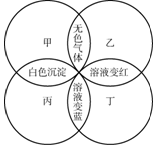 甲、乙、丙、丁分别是紫色石蕊试液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象如图所示.
甲、乙、丙、丁分别是紫色石蕊试液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象如图所示.