题目内容
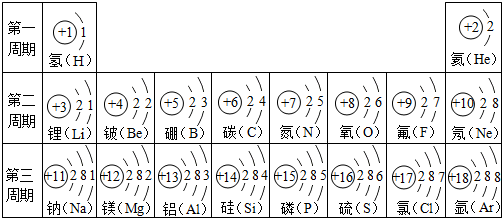
11.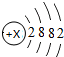 探究元素周期表可寻得一些规律.如图是一些元素的原子结构示意图.例:碳原子结构示意图的意思:6C表示6号元素碳,
探究元素周期表可寻得一些规律.如图是一些元素的原子结构示意图.例:碳原子结构示意图的意思:6C表示6号元素碳,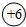 表示核内带6个单位正电荷,
表示核内带6个单位正电荷, 表示核外有6个电子,分两层排布,通常最外层电子数为8时较稳定.
表示核外有6个电子,分两层排布,通常最外层电子数为8时较稳定.(1)地壳中含量最多的元素是氧,它在化学反应中比较容易得(填“得”或“失”)电子.
(2)如图是某原子结构示意图,其中x值为20,它位于元素周期表里第四周期,该粒子的最外层电子数为2.
(3)第一族元素H、Li、Na易失去最外层1个电子,变成阳离子.
(4)原子序数为12和17的原子不属于同一种元素,原因是A不同(填字母).
A.质子数 B.相对原子质量
C.中子数 D.电子数
(5)根据表中第一、第二、第三周期的核外电子的排布规律和特点,谈谈第四周期元素的原子核外电子的排布可能的规律和特点原子核外电子层数相同或从左到右最外层电子数依次增加.
分析 (1)根据地壳中元素的含量以及其原子结构中最外层电子数来分析;
(2)原子中,核内质子数=核外电子数;元素周期表中电子层数=周期数,该粒子最外层电子数是2;
(3)根据离子的形成来分析;
(4)元素的种类是由核内质子数或核电荷数决定的;
(5)根据元素周期数与电子层数的关系、同一周期原子核外电子排布的变化进行分析解答.
解答 解:(1)地壳中含量最多的元素是氧元素,氧原子的最外层有6个电子,在化学反应中易得到电子,故填:氧;得;
(2)该原子的核外电子数是20,根据核内质子数=核外电子数,X=20;该原子有四个电子层,故位于第四周期,最外层电子数是2;故填:20;四;2;
(3)原子失去电子后,质子数<核外电子数,是带正电的阳离子;故填:阳;
(4)原子序数为12和17的原子不属于同一种元素,原因是质子数不同;故填:A.
(5)在同一周期中,各原子结构的共同之处是原子核外电子层数相同;该周期中,从左到右,各原子核外电子排布的变化规律是最外层电子数依次增加;故填:原子核外电子层数相同或从左到右最外层电子数依次增加(答案合理即可).
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息、了解粒子结构示意图的意义进行分析解题的能力.

练习册系列答案
相关题目
1.检验集气瓶中的CO2是否收集满的正确方法是( )
| A. | 向瓶内倒入澄清石灰水振荡 | B. | 在瓶口闻其气味 | ||
| C. | 将带火星的木条插入瓶里 | D. | 将燃着的木条放在瓶口 |
19.下列有关实验现象的描述与事实不相符的是( )
| A. | 木炭在氧气中燃烧发出白光 | |
| B. | 硫在空气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 铁丝在氧气中燃烧,火星四射,有黑色固体生成 | |
| D. | 蜡烛在空气中燃烧发出黄色火焰,稍有黑烟 |
6.如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )


| A. | 水分解后生成氢气和氧气的分子数目比为2:1 | |
| B. | 水分解过程中,原子的数目不变 | |
| C. | 一个水分子由二个氢原子和一个氧原子构成 | |
| D. | 水分解过程中,分子的种类不变 |
3.下列实验不能达到实验目的是( )
| A. |  蒸发滤液 | B. |  探究生锈的探究 | ||
| C. |  称量氯化钠的质量 | D. |  证明二氧化碳与水反应生成碳酸 |
20.化学实验中常常出现“1+l=2”或“l+l≠2”的有趣现象.下列符合“l+l=2”的事实是( )
| A. | 常温下,1L水与1L酒精混合后的体积等于2L | |
| B. | 室温下,1g镁与1g稀硫酸充分反应后所得的溶液质量为2g | |
| C. | 室温下,1g硫粉在lg氧气中完全燃烧后生成2g二氧化硫 | |
| D. | 20℃,lg氯化钠饱和溶液中加入1g氯化钠固体能得到2g氯化钠溶液 |


