题目内容
1.为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验.计算: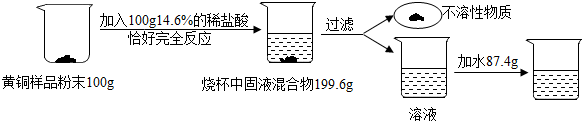
(1)该黄铜样品中铜的质量分数?
(2)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数?
(3)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是107g,在经过某些反应及操作就得到了所需铜盐.
分析 (1)根据质量守恒定律可以计算出反应生成氢气的质量,然后结合反应的化学方程式可以得出求锌的质量比例式;根据锌与杂质的质量分析铜的质量;
(2)反应后的溶液为氯化锌溶液,根据化学方程式结合溶液中溶质的质量分数的计算公式可以完成解答;
(3)根据铜和氧气反应的化学方程式结合铜的质量可以完成解答.
解答 解:(1)反应生成氢气的质量为:100g+100g-199.6g=0.4g
设合金中锌的质量为x,反应生成氯化锌的质量为y
Zn+2HCl═ZnCl2+H2↑
65 136 2
x y 0.4g
$\frac{65}{x}=\frac{136}{y}=\frac{2}{0.4g}$
x=13g
y=27.2g
(1)该黄铜样品中铜的质量分数=$\frac{100g-100g×7%-13g}{100g}×$100%=80%
(2)最终所得溶液中溶质的质量分数为:$\frac{27.2g}{100g+13+87.4g-0.4g}×$100%=13.6%
(3)铜锌合金中铜的质量为:100g×(1-7%)-13g=80g
设80g铜和氧气反应能够生成氧化铜的质量为a
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO
128 160
80g a
$\frac{128}{80g}=\frac{160}{a}$
解得:a=100g
所以可以得到含杂质的氧化铜的质量为:100g+100g×7%=107g.
故答案为:
(1)该黄铜样品中铜的质量分数80%;
(2)最终所得溶液中溶质的质量分数为13.6%;
(3)107g.
点评 本题主要考查了根据化学方程式的计算,要想解答好这类题目,就要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的物质的质量等知识.

 阅读快车系列答案
阅读快车系列答案| A. | 碳酸氢铵(NH4HCO3) | B. | 高锰酸钾(KMnO4) | ||
| C. | 硝酸钾(KNO3) | D. | 磷酸二氢钙{Ca(H2PO4)2} |
 地壳中含有丰富的氧、硅、铝、铁等元素.如图是四种元素的有关信息,关于四种元素的说法错误的是( )
地壳中含有丰富的氧、硅、铝、铁等元素.如图是四种元素的有关信息,关于四种元素的说法错误的是( )| A. | 氧元素的原子序数为8 | |
| B. | 铁元素属于金属元素 | |
| C. | 铝元素的原子在化学反应中易失去电子 | |
| D. | 硅元素的相对原子质量为28.09g |
| A. | 干冰气化 | B. | 蜡烛熔化 | C. | 大理石破碎 | D. | 粮食酿酒 |
 A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去):
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去):
 现有A〜G七种物质,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系:
现有A〜G七种物质,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系: