题目内容
17.如图所示的四个圆分别表示浓溶液、稀溶液、饱和溶液、不饱和溶液.
(1)通过对阴影A、B的分析,可以看出饱和溶液与浓溶液、稀溶液的关系是饱和溶液可能是浓溶液,也可能是稀溶液.
(2)0.9%的医用生理盐水可归于有图中的C区域(填A、B、C、D),现有一瓶接近饱和的氯化钠溶液,要使它变成饱和溶液,一般采用的方法是加入NaCl或蒸发溶剂.
分析 (1)饱和溶液和不饱和溶液的本质区别是:继续加入该溶质看能否溶解,和溶液的浓稀没有必然的关系.
(2)不饱和溶液转变为饱和溶液的方法有:改变温度,增加溶质或蒸发溶剂.
解答 解:(1)从图中可以看出饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液.所以饱和溶液与浓溶液、稀溶液的关系是:饱和溶液可能是浓溶液,也可能是稀溶液.
(2)0.9%的生理盐水因为浓度太小,所以是稀溶液;而且也不是饱和溶液,所以应该属于C区域;
接近饱和的NaCl溶液,要变为饱和溶液,采用的方法有:①加入NaCl或②蒸发溶剂.
故答案为:(1)饱和溶液可能是浓溶液,也可能是稀溶液;
(2)C;加入NaCl;蒸发溶剂.
点评 此题考查的是有关浓、稀溶液与饱和溶液、不饱和溶液的关系,饱和溶液和不饱和溶液的转化,很好的锻炼了学生对溶液部分基础知识的掌握.

练习册系列答案
相关题目
7.已知30℃时,Na2SO3在水中的溶解度为36g,在一定量Na2SO3的溶液中加入6.4g Na2SO3后,恰好为30℃的饱和溶液.若用Na2SO3•7H2O晶体代替Na2SO3,欲使原溶液在30℃时恰好饱和溶液,则需要加入的Na2SO3•7H2O的质量为( )
| A. | 12.8g | B. | 14.6g | C. | 20g | D. | 25g |
8. 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
硝酸钾溶解度
(1)A、B、C中一定是饱和溶液的是B,一定是不饱和溶液的是A;(填字母)
(2)当x=5.8g时,B中恰好没有固体剩余.
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答硝酸钾溶解度
| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
(2)当x=5.8g时,B中恰好没有固体剩余.
12. 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
 烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )
烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH值变化如图所示.则符合该变化的一组物质是( )| x | y | |
| A | NaOH溶液 | 稀HCl(过量) |
| B | 稀H2SO4 | BaCl2溶液(少量) |
| C | Ca(OH)2 | CO2(适量) |
| D | 稀H2SO4 | H2O |
| A. | A | B. | B | C. | C | D. | D |
6.下列实验操作正确的是( )
| A. | 制取蒸馏水时,将温度计玻璃球插入水中 | |
| B. | 过滤时,将玻璃棒靠在三层滤纸的一边 | |
| C. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 | |
| D. | 分离硝酸钾和氯化钠组成的混合物-利用硝酸钾和氯化钠分解温度不同 |
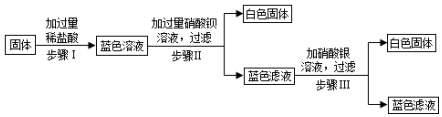
 在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.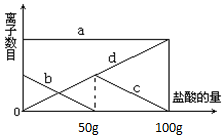 小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应
小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应