题目内容
8.20世纪20年代,丹麦和英国的一些化学家提出了新的酸碱理论--“质子论”.质子论认为:凡能放出质子(即H+)的分子或离子都是酸,凡能结合质子的分子或离子都是碱.根据这个理论,下列说法正确的是( )| A. | H2SO4属于酸 | B. | CO32-属于酸 | C. | NO3-属于碱 | D. | Na+属于碱 |
分析 本题根据质子论的观点:凡能放出质子(H+)的分子或离子都是酸,凡能结合质子(H+)的分子或离子都是碱来解答.
解答 解:A、因硫酸在水中电离产生H+和硫酸根离子,则H2SO4能放出质子(H+),即硫酸属于酸;
B、CO32-可与H+结合形成H2CO3,H2CO3不稳定分解成水和二氧化碳,CO32-属于碱;
C、NO3-能结合H+生成硝酸,所以属于碱;
D、Na+既不能放出也不能结合质子(H+),则Na+既不属于酸也不属于碱.
故选:A.
点评 本题较难,学生应正确利用新信息去认识酸和碱来完成习题,学生的难点是对HCO3-既属于酸又属于碱的认识.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
19.已知2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 被称为“铝热反应”.镁和氧化铜也能发生类似的反应,其化学方程式是Mg+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+MgO.
某小组同学在实验室中进行镁和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究.
【提出问题】固体剩余物是什么?
【猜想假设】假设①铜和氧化镁;假设②Cu、MgO和Mg;假设③Cu、MgO和CuO .
【查阅资料一】大多数金属氧化物都能与盐酸反应生成金属氯化物和水:
CuO+2HCl=CuCl2+H2O MgO+2HCl=MgCl2+H2O
【总结一】(1)对于有多种物质参加的化学反应,要推测充分反应后得到的剩余物的成分,需要考虑两个方面:一是反应的生成物;二是反应物是否过量.
(2)一种金属单质可以和另一种金属氧化物反应.
【思考】是否任何一种金属单质都能与另一种金属氧化物反应?
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息.
【总结二】根据上表对比分析得出:金属单质与金属氧化物能发生反应,需满足的条件是金属单质的活动性要比氧化物中的金属的活动性强.
某小组同学在实验室中进行镁和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究.
【提出问题】固体剩余物是什么?
【猜想假设】假设①铜和氧化镁;假设②Cu、MgO和Mg;假设③Cu、MgO和CuO .
【查阅资料一】大多数金属氧化物都能与盐酸反应生成金属氯化物和水:
CuO+2HCl=CuCl2+H2O MgO+2HCl=MgCl2+H2O
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀盐酸. | (1)固体部分溶解,溶液为无色. | 假设①成立.[来 |
| (2)固体部分溶解,有气体生成,溶液为无色. | 假设②成立. | |
| (3)固体部分溶解,溶液为蓝色. | 假设③成立. |
(2)一种金属单质可以和另一种金属氧化物反应.
【思考】是否任何一种金属单质都能与另一种金属氧化物反应?
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息.
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
20.科学研究时,常常用易观测的量显示不易直接观测的量,下列不是应用这一方法的是( )
| A. |  以不同球说明分子结构 | B. |  以水位表示氧气含量 | ||
| C. |  以水银柱升高判断叶蒸腾快慢 | D. |  以铁屑数目说明磁性强弱 |
18.“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6 价的铬.下列铬的化合物中铬呈+6 价的是( )
| A. | Cr2(SO4)3 | B. | Cr2O3 | C. | K2Cr2O7 | D. | Cr(OH)3 |
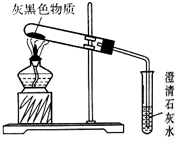 镁是一种银白色的金属,但实验室看到的镁条常常有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?甲同学认为是MgO;乙同学认为是Mg2(OH)2CO3;丙同学认为是Mg(OH)2.
镁是一种银白色的金属,但实验室看到的镁条常常有一层灰黑色的“外衣”,这层灰黑色的外衣是什么物质呢?甲同学认为是MgO;乙同学认为是Mg2(OH)2CO3;丙同学认为是Mg(OH)2.

