题目内容
17.下列实验或现象不能证明空气中含有水份的是( )| A. | 松脆的饼干放在空气中两三天就变软了 | |
| B. | 对着干燥的玻璃片呼气,玻璃片上有水雾 | |
| C. | 从冰柜中拿出的雪碧放在空气中,表面会有水珠 | |
| D. | 早晨起来,看到小草上有露珠 |
分析 根据常见的空气的成分中的水蒸气的证明方法进行分析判断即可.
解答 解:
A、干脆的饼干在空气中一段时间会变软,说明空气中有水蒸气.
B、对着一片干燥的玻璃吹气,玻璃片上出现一层水雾,说明人呼出的气体中含有水蒸气,不能证明空气中有水蒸气.
C、从冰柜中拿出的雪碧放在空气中,表面会有水珠,是空气中的水蒸气冷凝形成的.说明空气中有水蒸气.
D、夏天清晨,花园绿地中草上有很多露珠,是空气中的水蒸气冷凝形成的.说明空气中有水蒸气.
故选B.
点评 本题结合生活实际,考查了空气中水蒸气的证明方法,考查了学生分析问题、解决问题的能力.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
5.预防流感现在最有效的预防方法之一就是用消毒液对空气消毒.深圳市科瑞德用品公司生产二氧化氯消毒液,是国际上公认的新一代强力,光谱,安全,高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂,二氧化氯消毒液能够迅速,彻底杀灭各种细菌(大肠杆菌,白色念珠菌等)和病毒(肝炎病毒,流感病毒等).某校决定放学后对全校教室、寝室全面消毒.小陈观察到瓶上的标签如表所示.
求:(1)这1000毫升二氧化氯消毒液的质量是1200克,其中含溶质二氧化氯960克.
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少?(保留小数点一位)
(3)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?
| 二氧化氯(ClO2)1000毫升 | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2克/厘米3 |
| 相对分子质量 | 67.5 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少?(保留小数点一位)
(3)欲配制30千克质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少千克这种二氧化氯消毒液和多少千克水?
12.下列实验操作正确的是( )
| A. |  熄灭酒精灯 | B. |  闻气体气味 | C. |  倾倒液体 | D. |  稀释浓硫酸 |
2.安全意识,是人类生存所必须具有的基本素质之一.下列实验操作比较安全的是( )
| A. | 实验中不慎把酒精洒在实验桌上,迅速用湿抹布扑灭 | |
| B. | 用鼻子直接凑到容器口嗅未知气体的气味 | |
| C. | 用嘴品尝未知物质的味道 | |
| D. | 为缩短实验时间,点燃氢气时不需要验纯 |
9.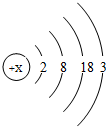 阅读材料,回答问题:
阅读材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(下表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g•cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0g•cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g•cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图,常见化合价为+3.
(1)镓元素的质子数为31,其原子最外层电子数为3;
(2)写出氯化镓的化学式为GaCl3
(3 )请根据上述材料,总结金属镓的有关知识:
物理性质:银白色金属,密度为5.94g•cm-3;
化学性质(请用化学方程式表示):2Ga+6H2O $\frac{\underline{\;\;△\;\;}}{\;}$2Ga(OH)3+3H2↑;;
用途:制造半导体材料;
(4)请从上述周期表片断中查出硅元素的一种数据,并指出其含义:相对原子质量(原子量)为28.09 或 质子数(原子序数、核电荷数)为14;
(5)上述材料中,化学家所使用的研究方法及其关系是镓元素的发现应用了实验研究方法.
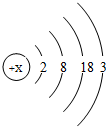 阅读材料,回答问题:
阅读材料,回答问题:材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(下表是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
| 13 Al 铝 26.98 | 14 Si 硅 28.09 |
| 类铝 | 类硅 |
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g•cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图,常见化合价为+3.
(1)镓元素的质子数为31,其原子最外层电子数为3;
(2)写出氯化镓的化学式为GaCl3
(3 )请根据上述材料,总结金属镓的有关知识:
物理性质:银白色金属,密度为5.94g•cm-3;
化学性质(请用化学方程式表示):2Ga+6H2O $\frac{\underline{\;\;△\;\;}}{\;}$2Ga(OH)3+3H2↑;;
用途:制造半导体材料;
(4)请从上述周期表片断中查出硅元素的一种数据,并指出其含义:相对原子质量(原子量)为28.09 或 质子数(原子序数、核电荷数)为14;
(5)上述材料中,化学家所使用的研究方法及其关系是镓元素的发现应用了实验研究方法.
 有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出20g溶液,加入足量的锌粒.充分反应后,产生的氢气为0.02g.
有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出20g溶液,加入足量的锌粒.充分反应后,产生的氢气为0.02g.