题目内容
钢铁是使用最多的金属材料.在今年的化学活动周中,某校兴趣小组的同学在老师指导下对铁的相关性质和用途进行了研究.

(1)如图1所示的铁制品的用途中,利用金属导热性的是 (填字母,下同).
(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是 .
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(3)为防止水龙头生锈,其表面镀有一层铬.铁生锈的条件是 、 .
(4)将一小块生铁放入盛有过量稀盐酸的烧杯中,完全反应.写出其中的化学方程式 ,烧杯底留下的黑色残渣是 .
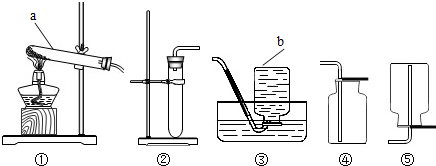
(5)实验:用干燥纯净的一氧化碳还原氧化铁,如图2所示.其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:H2C2O4
H2O+CO2↑+CO↑.请回答下列问题:
①B装置中发生反应的化学方程式是 .
②C装置无明显现象,C装置的作用是 .D装置中浓硫酸的作用是 .
③E装置中的实验现象是 .
④F装置的作用是 、 .
⑤为了防止溶液倒吸,本实验停止加热前是否需要先断开E和F的连接处? (填“需要”或“不需要”),理由是 .
⑥利用这套装置还可以测定氧化铁样品中氧化铁的质量分数.他们的测定方法是:称量氧化铁样品的质量10.0g,样品与玻璃管的总质量为60.0g,完全反应并冷却后再称量玻璃管与剩余固体的总质量为57.9g.计算实验测得氧化铁样品中氧化铁的质量分数为 .

(1)如图1所示的铁制品的用途中,利用金属导热性的是
(2)目前世界上已有50%以上的废钢铁得到回收利用,其目的是
A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈
(3)为防止水龙头生锈,其表面镀有一层铬.铁生锈的条件是
(4)将一小块生铁放入盛有过量稀盐酸的烧杯中,完全反应.写出其中的化学方程式
(5)实验:用干燥纯净的一氧化碳还原氧化铁,如图2所示.其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的化学方程式是:H2C2O4
| ||
| △ |
①B装置中发生反应的化学方程式是
②C装置无明显现象,C装置的作用是
③E装置中的实验现象是
④F装置的作用是
⑤为了防止溶液倒吸,本实验停止加热前是否需要先断开E和F的连接处?
⑥利用这套装置还可以测定氧化铁样品中氧化铁的质量分数.他们的测定方法是:称量氧化铁样品的质量10.0g,样品与玻璃管的总质量为60.0g,完全反应并冷却后再称量玻璃管与剩余固体的总质量为57.9g.计算实验测得氧化铁样品中氧化铁的质量分数为
考点:金属的物理性质及用途,气体的净化(除杂),金属的化学性质,一氧化碳还原氧化铁,金属锈蚀的条件及其防护,金属的回收利用及其重要性,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)根据铁的用途,分析利用了铁的什么性质;
(2)根据钢铁回收利用的意义,选择钢铁回收利用的目的;
(3)解释铁生锈的原因;
(4)分析题干说明,写出变化中反应的化学方程式;
(5)①氢氧化钠溶液吸收二氧化碳生成二氧化碳与水;②澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;浓硫酸具有很好的吸水性;③根据一氧化碳还原氧化铁的生成物考虑;④澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;⑤根据玻璃管中气体的压强变化进行分析解答;⑥中氧化铁还原为铁,质量减轻,运用差量法可求出氧化铁的质量,再利用质量分数公式求算.
(2)根据钢铁回收利用的意义,选择钢铁回收利用的目的;
(3)解释铁生锈的原因;
(4)分析题干说明,写出变化中反应的化学方程式;
(5)①氢氧化钠溶液吸收二氧化碳生成二氧化碳与水;②澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;浓硫酸具有很好的吸水性;③根据一氧化碳还原氧化铁的生成物考虑;④澄清石灰水遇二氧化碳变浑浊,可用来检验二氧化碳的存在;⑤根据玻璃管中气体的压强变化进行分析解答;⑥中氧化铁还原为铁,质量减轻,运用差量法可求出氧化铁的质量,再利用质量分数公式求算.
解答:解:(1)铁锤和水龙头利用了硬度大等性质,铁丝利用了延展性,炊具是利用其导热性的;
(2)回收利用金属是为了节约金属资源;
(3)表面镀有一层铬可以防止铁与氧气和水的接触,起到防止铁生锈的目的;
(4)生铁中含有少量的碳,碳与稀盐酸不反应,铁与盐酸反应产生了氢气,同时生成氯化亚铁;
(5)①根据化学方程式:H2C2O
H2O+CO2↑+CO↑可知,有CO2生成,B装置中的氢氧化钠溶液可以吸收二氧化碳气体,化学反应式是:2NaOH+CO2=Na2CO3+H2O;
②C装置中的澄清石灰水遇二氧化碳变浑浊,而C装置中无明显现象,说明二氧化碳已被氢氧化钠溶液完全吸收;D装置中浓硫酸的作用是吸收制取CO过程中产生的水,得到干燥的CO;
③E装置中的氧化铁在CO的还原作用下,由红色的氧化铁粉末变成黑色的铁粉;
④F装置中的澄清石灰水遇二氧化碳变浑浊,可以用来证明二氧化碳的存在;点燃尾气,是因为过量的有毒一氧化碳会污染空气,所以要进行尾气处理;
⑤不需要断开,因为一直通入一氧化碳;
⑥原有样品为氧化铁(10g),玻璃管的质量为50g,故反应后为剩余固体为(7.9g),减少的质量为2.1g,实质就是氧元素的质量,运用差量法解题.
设氧化铁的质量为x
3CO+Fe2O3
3CO2+2Fe△m
160 112 48
x (60.0-57.9)g
=
解得,x=7g
氧化铁的质量分数为:
×100%=70%
故答案为:(1)B;(2)A;(3)铁与氧气;水蒸气接触;(4)Fe+2HCl═FeCl2+H2↑;C;
(5)①2NaOH+CO2=Na2CO3+H2O;②证明二氧化碳已被完全吸收;干燥一氧化碳气体;③红色粉末变成黑色;④证明反应生成了二氧化碳;尾气处理;
⑤不需要;一直通CO;⑥70%
(2)回收利用金属是为了节约金属资源;
(3)表面镀有一层铬可以防止铁与氧气和水的接触,起到防止铁生锈的目的;
(4)生铁中含有少量的碳,碳与稀盐酸不反应,铁与盐酸反应产生了氢气,同时生成氯化亚铁;
(5)①根据化学方程式:H2C2O
| ||
| △ |
②C装置中的澄清石灰水遇二氧化碳变浑浊,而C装置中无明显现象,说明二氧化碳已被氢氧化钠溶液完全吸收;D装置中浓硫酸的作用是吸收制取CO过程中产生的水,得到干燥的CO;
③E装置中的氧化铁在CO的还原作用下,由红色的氧化铁粉末变成黑色的铁粉;
④F装置中的澄清石灰水遇二氧化碳变浑浊,可以用来证明二氧化碳的存在;点燃尾气,是因为过量的有毒一氧化碳会污染空气,所以要进行尾气处理;
⑤不需要断开,因为一直通入一氧化碳;
⑥原有样品为氧化铁(10g),玻璃管的质量为50g,故反应后为剩余固体为(7.9g),减少的质量为2.1g,实质就是氧元素的质量,运用差量法解题.
设氧化铁的质量为x
3CO+Fe2O3
| ||
160 112 48
x (60.0-57.9)g
| 160 |
| 48 |
| x |
| 2.1g |
解得,x=7g
氧化铁的质量分数为:
| 7g |
| 10g |
故答案为:(1)B;(2)A;(3)铁与氧气;水蒸气接触;(4)Fe+2HCl═FeCl2+H2↑;C;
(5)①2NaOH+CO2=Na2CO3+H2O;②证明二氧化碳已被完全吸收;干燥一氧化碳气体;③红色粉末变成黑色;④证明反应生成了二氧化碳;尾气处理;
⑤不需要;一直通CO;⑥70%
点评:考查了金属性质,锈蚀条件及其防护,属于结合课本知识的信息.要知道金属锈蚀的条件和防止金属制品生锈的措施,并结合生活实际,选择比较好防止金属生锈的措施和保护金属资源的方法,并知道金属回收的重要意义.还考查一氧化碳还原氧化铁的实验装置及相关问题,属于课本基本实验的延伸,难度不大,要明确实验的目的及试剂的作用.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下列各类特产中富含蛋白质的是( )
| A、亳州古井贡 | B、黄山猕猴桃 |
| C、阜阳枕头馍 | D、巢湖银鱼 |



 表示的是(填名称)
表示的是(填名称)