题目内容
10.请结合如图实验装置,回答下列问题.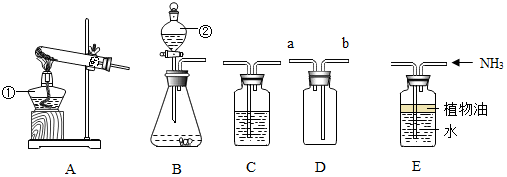
(1)写出有标号的仪器名称:①酒精灯,②分液漏斗.
(2)用高锰酸钾制氧气选用的发生装置是A(选填序号),反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若B装置中固体为锌粒,②中加入稀硫酸可制H2.要获得较干燥的H2,用D装置收集,气体应从a端通入(选填“a”或“b”).说明氢气的密度小于空气的密度(填大于、小于).
(4)实验室可用B装置制CO2,将气体通过盛有紫色石蕊的C装置,观察到的现象是溶液由紫色变为红 色,反应的化学方程式为CO2+H2O=H2CO3,若用B制取氧气,反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
(5)若用E装置收集NH3,必须油封其作用是防止NH3溶于水.说明NH3能溶于水.
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气;
(3)通常情况下,锌和稀硫酸反应生成硫酸锌和氢气,氢气难溶于水,密度比空气小;浓硫酸具有吸水性,可以用作氢气、氧气、二氧化碳等气体的干燥剂;
(4)根据二氧化碳与水反应,生成碳酸,碳酸能使紫色石蕊溶液变红解答;根据B是固液常温型,可以用过氧化氢和二氧化锰制取氧气解答;
(5)氨气易溶于水,不溶于植物油.
解答 解:(1)①是酒精灯,常用作热源;②是分液漏斗,通过分液漏斗可以向反应容器中注入液体药品.
故填:酒精灯;分液漏斗.
(2)用高锰酸钾制氧气需要加热,应该选用的发生装置是A,反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)若B装置中固体为锌粒,液体是稀硫酸时可制H2;
要获得干燥的H2,应先将气体通过盛有浓硫酸的D装置,再用E装置收集,由于氢气的密度比空气小,气体应从a端通入.
故填:液体是稀硫酸;浓硫酸;a.
(4)实验室可用B装置制CO2,将气体通过盛有紫色石蕊的C装置,观察到的现象是溶液由紫色变为红色,反应的化学方程式为:CO2+H2O=H2CO3;
B是固液常温型,可以用过氧化氢和二氧化锰制取氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
实验室可用B或C装置制CO2,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(5)若用F装置收集NH3,油层的作用是防止氨气溶于水.说明氨气能溶于水.
答案:
(1)酒精灯;分液漏斗.
(2)A;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)稀硫酸;a;小于;
(4)红色;CO2+H2O=H2CO3;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
(5)防止NH3溶于水;能.
点评 本题主要考查仪器的用途、反应表达式的书写,实验装置的选择,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、能否和水发生化学反应、密度、能否和空气中的物质发生化学反应等因素.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案 学习了“酸能使紫色石蕊试液变色”的知识后,为深入研究某一问题,小科设计了如图所示的实验,下列说法错误的是( )
学习了“酸能使紫色石蕊试液变色”的知识后,为深入研究某一问题,小科设计了如图所示的实验,下列说法错误的是( )| A. | 实验目的:探究盐酸中的哪种粒子能使紫色石蕊试液变色 | |
| B. | 实验现象:乙试管中的溶液将变红,甲、丙试管中的溶液不变色 | |
| C. | 实验分析:甲、乙对比探究Cl-能使紫色石蕊试液变色 | |
| D. | 实验结论:能使紫色石蕊试液变色的是盐酸中的H+ |
| A. | 加热试管中的液体时,液体的体积少于试管容积的1/3 | |
| B. | 用托盘天平称量时,把称量物放在右盘,把砝码放在左盘 | |
| C. | 实验后用剩的药品,应放回原试剂瓶中 | |
| D. | 实验完毕后先用嘴吹灭酒精灯,再盖好灯帽 |
| A. | 银粉中混有铁粉(硫酸铜溶液) | |
| B. | 氯化钠中混有碳酸钠(盐酸溶液) | |
| C. | 氯化铜溶液中混有氯化亚铁(铜粉) | |
| D. | 二氧化碳气体中混有氧气(氢氧化钠溶液) |
 构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )
构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“-”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A、B、C分别属于不同类别的化合物.则A、B、C可能是( )| A. | KOH、CuSO4、Na2CO3 | B. | Ba(OH)2、CuSO4、CuO | ||
| C. | Ca(OH)2、HNO3、K2CO3 | D. | NaOH、HCl、Ba(NO3)2 |




 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答: