题目内容
5.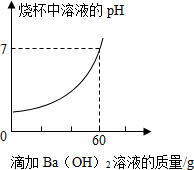 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如表所示:(已知BaCl2溶液的pH=7)
某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH变化的部分数据如表所示:(已知BaCl2溶液的pH=7)| 滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 |
| 烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 |
(1)完全反应后生成沉淀的质量为4.66g;
(2)计算该洁厕灵溶液中HCl的质量分数为多少?(计算结果保留至0.1%)
分析 盐酸与氢氧化钡溶液反应生成氯化钡和水,硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;由图示可知,恰好完全反应时,消耗的氢氧化钡溶液的质量为60g,滴加氢氧化钡溶液的质量为25g时,产生的沉淀的质量为4.66g,据此结合反应的化学方程式进行分析解答即可.
解答 解:由题意可知:H2SO4完全反应后产生BaSO4沉淀的质量是4.66g;
由题意可知:滴加10g氢氧化钡溶液时,产生沉淀2.33g,则产生4.66g沉淀,消耗氢氧化钡溶液的质量为20g;则与HCl完全反应的Ba(OH)2溶液的质量为:60g-20g=40g.
设20g该品牌洁厕灵溶液中HCl的质量为y.
Ba(OH)2+2HCl=BaCl2+2H2O
171 73
40g×17.1% y
$\frac{171}{40g×17.1%}$=$\frac{73}{x}$
y=2.92g
该洁厕灵溶液中HCl的质量分数为:$\frac{2.92g}{20g}$×100%=14.6%.
故答案为:(1)4.66g
(2)14.6%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析图表信息,根据找出生成硫酸钡沉淀的质量是正确解答本题的前提和关键.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
15.如表是NaOH的溶解度数据,请回答下列问题:
(1)将18gNaOH加入到20g水中,温度升高到60℃,升温的原因是NaOH溶于水放出热量.充分溶解后再降温至20℃,NaOH固体没有(选填“有”或“没有”)析出.
(2)20℃时,95gNaOH的饱和溶液加入130g水可得到20%的溶液.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 90 | 111 | 130 | 313 | 336 |
(2)20℃时,95gNaOH的饱和溶液加入130g水可得到20%的溶液.
16.废旧手机的某些部件中含有Mg、Al、Cu、Ag等金属,为了回收重金属,将旧手机的部件粉碎并浸入足量稀硫酸中充分反应过滤,所得固体中含有的金属是( )
| A. | Mg Al | B. | A1 Cu | C. | Cu Ag | D. | Mg Ag |
13. 如图表示某陨石样品中各种元素含量,此陨石样品中不可能含有的化合物是( )
如图表示某陨石样品中各种元素含量,此陨石样品中不可能含有的化合物是( )
 如图表示某陨石样品中各种元素含量,此陨石样品中不可能含有的化合物是( )
如图表示某陨石样品中各种元素含量,此陨石样品中不可能含有的化合物是( )| A. | Al2O3 | B. | SiO2 | C. | CaSO4 | D. | KOH |
17.如图是一定条件下某反应的微观模拟示意图,按图分析下列说法错误的是( )

| A. | 反应前后原子的数目不变 | |
| B. | 反应后物质总质量增加 | |
| C. | 该反应的生成物均不属于大气污染物 | |
| D. | 该反应为置换反应 |

