题目内容
6.纳米碳酸钙常用作牙膏摩擦剂,如图是某厂生产纳米碳酸钙的工艺流程.
(1)将氯化钙制成溶液的目的是降低反应物的浓度,溶解过程中玻璃棒的用途是搅拌加速溶解.
(2)该工艺中需要大量二氧化碳,工作上常用分解石灰石的方法制取二氧化碳,其原理是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑(用化学方程式表示).为了等到更多的碳酸钙,应先通氨气,在通二氧化碳,其原因是氨气极易溶于水,形成的氨水呈碱性,能充分吸收CO2.
(3)上述流程中操作2包括过滤、洗涤和干燥,流程中的另一种产品可用作氮肥(写一种用途).
分析 (1)根据题干中对制备的物质的要求来分析;
(2)碳酸钙高温生成氧化钙和二氧化碳;氨气易溶于水,所得溶液显碱性;
(3)根据分离混合物并进一步提纯的方法以及氯化铵的用途来分析.
解答 解:(1)将氯化钙制成溶液可以降低反应物的浓度,避免生成的碳酸钙相互凝结成大颗粒,进而得到非聚集状态的纳米级碳酸钙;在溶解过程中,要用玻璃棒不断地搅拌,目的是加速溶解;故填:降低反应物的浓度;搅拌加速溶解;
(2)碳酸钙高温生成氧化钙和二氧化碳,反应条件是高温,所以方程式是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;先通入氨气,所得溶液显碱性,能吸收更多的二氧化碳气体;故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,氨气极易溶于水,形成的氨水呈碱性,能充分吸收CO2;
(3)由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,最后干燥即可;氯化铵中含有氮元素,可以做氮肥;故填:干燥,氮肥.
点评 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,物质的提纯方法和氯化铵的用途.

练习册系列答案
相关题目
11.在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如表:
且X的相对分子质量为n,Q的相对分子质量为2n,则下列推理不正确的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 4 | 10 | 1 | 21 |
| 反应后质量/g | 0 | 12 | 15 | 待测 |
| A. | 该反应不可能是分解反应 | |
| B. | 反应后生成14gZ | |
| C. | 参加反应的X与Q的质量比是1:3 | |
| D. | 该反应方程式中X与Q的化学计量数比为3:2 |
12.向盛有碳酸钠溶液(滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,在不同阶段测定所得溶液的pH和蒸干所得白色固体成分进行分析,下列说法不正确的是( )
| A. | 若反应后的溶液的 pH≤7,蒸干后得到的白色固体只有氯化钠 | |
| B. | 向白色固体中滴入稀盐酸,有气泡说明原反应后的溶液 pH>7 | |
| C. | 若反应后的溶液显无色,说明稀盐酸和碳酸钠恰好完全反应 | |
| D. | 当没有气泡产生时,说明稀盐酸和碳酸钠恰好完全反应 |
11.下列说法不正确的是( )
| A. | 青铜是人类最早使用的合金 | |
| B. | 缺钙会引起骨质疏松 | |
| C. | 法国化学家拉瓦锡第一次明确提出空气是由氧气和氮气组成的 | |
| D. | “白色污染”是指白色建筑材料垃圾引起的污染 |
18.下列各组物质间不能发生反应的是( )
| A. | 氢氧化钠溶液和氯化钾溶液 | B. | 氯化钙溶液和纯碱溶液 | ||
| C. | 硫酸铜溶液和氯化钡溶液 | D. | 氧化钙和稀硫酸 |

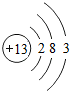 ,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.
,该原子在化学反应中易失(填“得”或“失”)电子,形成的离子符号为Al3+铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+X↑+2H2O,则X的化学式为SO2.
