题目内容
9.下列物质中有一种与其他三种物质都能发生反应,它是( )| A. | 锌粒 | B. | 碳酸钙 | C. | 稀盐酸 | D. | 氢氧化钾 |
分析 利用物质的性质,判断物质间是否可以发生反应;酸可以与金属单质发生置换反应,酸可与某些盐反应复分解反应,可以与碱发生中和反应,据此分析解答即可.
解答 解:四种物质中只有盐酸可以与锌反应生成氢气,与碳酸钙反应生成氯化钙、水与二氧化碳,与氢氧化钾反应生成氯化钾与水,其他物质均不具备能跟其他三种物质反应.
故选C.
点评 该题主要是对物质之间反应的考查,解题的关键是对相关的物质之间的反应通过化学常识及物质之间的反应规律进行分析判断.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
19.在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块.于是对其成分进行科学探究,请你一起完成探究的过程.
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因CO2+2NaOH═Na2CO3+H2O.
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图1所示实验.

甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠.
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中溶液变红,B试管出现大量气泡,C试管中出现白色沉淀;C试管中现象产生的原因是(用化学方程式表示)Na2CO3+BaCl2=BaCO3↓+2NaCl.
(2)乙同学认为甲同学的结论是不正确的,原因是碳酸钠溶液呈碱性,也是无色酚酞变红.
【实验设计】请你设计合理的实验方案,填入下列表格中.
Ⅱ固体中各成分含量
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图2(I)所示实验.
(1)在量气管内水面上架一薄层油,目的是防止二氧化碳溶于水;将Y形管(装置A)向左倾斜,硫酸流到样品中.
(2)使样品与稀硫酸反应的操作为将Y形管(装置A)向左倾斜,硫酸流到样品中.
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4mL(已知该温度压强下,CO2的密度为1.965g/L),请你计算出样品中Na2CO3质量分数.(写出计算过程)
(4)小明同学设计如图2(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是逸出的二氧化碳中含有水蒸汽.
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠.
用化学方程式表示固体中有碳酸钠的原因CO2+2NaOH═Na2CO3+H2O.
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图1所示实验.

甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠.
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中溶液变红,B试管出现大量气泡,C试管中出现白色沉淀;C试管中现象产生的原因是(用化学方程式表示)Na2CO3+BaCl2=BaCO3↓+2NaCl.
(2)乙同学认为甲同学的结论是不正确的,原因是碳酸钠溶液呈碱性,也是无色酚酞变红.
【实验设计】请你设计合理的实验方案,填入下列表格中.
| 操作 | 现象 | 结论 |
| 取少量结块固体于试管(或烧杯)中,加水使其完全溶解,加入过量的氯化钡或氯化钙溶液,静置后,向上层清液(或过滤后向滤液)中滴加几滴无色酚酞溶液 | 若溶液变红 | 固体为碳酸钠和氢氧化钠 |
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图2(I)所示实验.
(1)在量气管内水面上架一薄层油,目的是防止二氧化碳溶于水;将Y形管(装置A)向左倾斜,硫酸流到样品中.
(2)使样品与稀硫酸反应的操作为将Y形管(装置A)向左倾斜,硫酸流到样品中.
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4mL(已知该温度压强下,CO2的密度为1.965g/L),请你计算出样品中Na2CO3质量分数.(写出计算过程)
(4)小明同学设计如图2(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是逸出的二氧化碳中含有水蒸汽.
20.决定元素化学性质的是( )
| A. | 质子数 | B. | 中子数 | C. | 电子总数 | D. | 最外层电子数 |
17.为了测定某生铁样品中铁的质量分数,某化学兴趣小组取生铁样品10g,将200g稀硫酸粉4次加入样品中,称得剩余固体的质量与所加稀硫酸的质量关系如下图所示:
(1)求生铁样品中铁的质量.
(2)计算所用稀硫酸的溶质质量分数.
| 所用稀硫酸的质量(g) | 50 | 50 | 50 | 50 |
| 剩余固体的质量(g) | 7.2 | 4.4 | 1.6 | 0.2 |
(2)计算所用稀硫酸的溶质质量分数.
4.下列实验操作中错误的是( )
| A. |  蒸发结晶 | B. |  稀释浓硫酸 | ||
| C. |  滴管用后不洗插回原瓶 | D. |  用力塞紧橡皮塞 |
14.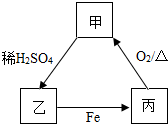 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )
 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )| A. | 铜 | B. | 碳酸钠 | C. | 氧化铜 | D. | 氢氧化钡 |
19.下列图象与对应的叙述相符合的是( )
| A. |  等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 | |
| B. |  向H2SO4和MgSO4的混合溶液中滴加NaOH溶液 | |
| C. |  向pH=13的氢氧化钠溶液中不断加入稀硫酸 | |
| D. |  化学反应中,原子总数随时间的变化 |
 组成相似的盐具有一些相似的化学性质.
组成相似的盐具有一些相似的化学性质. ”代表的是硫酸根离子(填名称).
”代表的是硫酸根离子(填名称).