题目内容
3.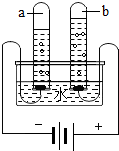 小华和小慧两位同学分别用如图所示的装置进行电解水实验.该反应的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.为了增强水的导电性,实验前小华向水中加入硫酸钠固体.则b试管中产生的气体是O2(填化学式),检验这种气体的方法是带火星的木条.
小华和小慧两位同学分别用如图所示的装置进行电解水实验.该反应的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.为了增强水的导电性,实验前小华向水中加入硫酸钠固体.则b试管中产生的气体是O2(填化学式),检验这种气体的方法是带火星的木条.小慧在做实验时误将氯化钠当成硫酸钠加入水中,结果在检验b气体时闻到一股刺激性气味.在老师的指导下小华和小慧一起就这一异常现象开展了研究.
【定性研究】
1.小慧猜想刺激性气味气体是氯化氢或氨气.小华则认为一定不是氨气,理由是根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气.
在老师指导下得知:①食盐水通电时发生反应:2NaCl+2H2O═2NaOH+H2↑+Cl2↑;
②氯气是一种有刺激性气味的有毒气体.由此可推测该刺激性气味的气体是氯气.
2.定剩余溶液中的溶质,小慧进行如下实验,请帮她将实验报告补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量剩余溶液,滴入氯化铜溶液. | 产生蓝色絮状沉淀 | 溶液中含有氢氧化钠 |
| ②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液 | 产生白色沉淀 | 溶液中含有氯化钠 |
【定量研究】
两位同学按如图所示的实验步骤进行实验:
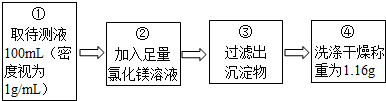
(1)步骤②加入的氯化镁溶液必需足量,其目的是.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,(写出实验步骤、现象和结论).
(2)计算待测液中氢氧化钠的质量分数(写出计算过程).
(3)若步骤④中缺少洗涤干燥的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
分析 根据水电解实验的原理、现象及产物检验进行分析,氧气可用带火星木条检验,氢气可用燃着的木条检验;
【定性研究】Ⅰ、根据质量守恒定律进行分析;
Ⅱ、①根据产生蓝色絮状沉淀为氢氧化铜进行分析;
②根据氯离子的检验进行分析;
【定量研究】(1)根据氢氧化钠的性质,氯化镁的性质进行分析;
(2)根据质量分数的计算进行分析;
(3)根据影响计算结果的因素进行分析.
解答 解:电解水生成氢气和氧气,反应的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
电解水时,正极产生氧气,负极产生氢气,二者的体积比水1:2;b中气体体积小为氧气,能使带火星木条复燃;
【定性研究】Ⅰ、根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;故填:根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;
食盐水在通电时发生反应:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$↑NaOH+H2↑+Cl2↑,氯气是种有刺激性气味的有毒气体,所以该气体为氯气;
Ⅱ、①取少量剩余溶液,滴入氯化铜溶液,产生蓝色絮状沉淀,为氢氧化铜,所以溶液中含有氢氧化钠;故填:氢氧化钠;
②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,为氯化银,说明溶液中含有氯离子;
在①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;故填:①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;
【定量研究】(1)氢氧化钠和氯化镁反应,生成氯化钠和氢氧化镁,加入氯化镁溶液必需足量,目的是使氢氧化钠完全反应;判断所加氯化镁溶液是否过量的具体操作:静置,取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;故填:使氢氧化钠完全反应;取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;
(2)设参加反应的氢氧化钠质量为x
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58
x 1.16g
$\frac{80}{x}=\frac{58}{1.16g}$
待测液中氢氧化钠的质量分数=$\frac{1.6g}{100g}$×100%=1.6%;
(3)若步骤④中缺少洗涤干燥的操作,会使氢氧化镁中含有杂质,使质量增大,从而使计算的氢氧化钠质量增大;故填:偏大;
故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;O2;带火星的木条;
【定性研究】Ⅰ、①根据质量守恒定律,反应前后元素的种类不变,反应物中没有氮元素,所以不可能生成氨气;②氯气;
Ⅱ、①氢氧化钠;
②产生白色沉淀;
①的反应中氯化铜和氢氧化钠反应,生成氯化钠和氢氧化铜,生成物中有氯化钠,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液,产生白色沉淀,所以不能证明原溶液中含有氯化钠;
【定量研究】(1)使氢氧化钠完全反应;取上层溶液,滴加氢氧化钠溶液,如果产生白色沉淀,说明氯化镁过量,如果没有明显现象,说明氯化镁不过量;
(2)16%;
(3)偏大.
点评 明确水电解的原理、实验现象和结论解答本题关健.记住电解水时正氧负氢,氢二氧一;氢气具有可燃性,点燃时可能发生爆炸,点燃前要验纯是解答本题关键.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案(1)提出问题:氢氧化钙是否变质?
(2)猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质;完全变质.
(3)实验探究:
| 实验步骤及操作 | 实验现象 | 实验结论 |
| 取样于试管中,加入足量蒸馏水振荡,静置 ①取上层清液,滴入无色酚酞试液 ②倒去上层清液,再向试管中注入稀 盐酸 | ①无色酚酞试液变红 ②有大量的气泡冒出 | 部分变质 |
| ①无色酚酞试液不变红 ②有大量的气泡冒出 | 全部变质 | |
| ①无色酚酞试液变红 ②没有气泡产生 | 没有变质 |
①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出实验中反应的化学方程式Ca(OH)2+2HCl=CaCl2+2H2O、CaCO3+2HCl═CaCl2+CO2↑+H2O.
②氢氧化钙俗称熟石灰,它的水溶液在实验室通常用来检验二氧化碳气体.
| A. | 杯内壁看不到污物,呈无色透明状 | |
| B. | 冲洗时倒出的水是无色透明的 | |
| C. | 杯内壁的水既不成股流下也不聚滴 | |
| D. | 上述中的任意一种标志均表示玻璃杯已经洗净 |
【提出问题】溶液中的溶质是什么物质?
【做出猜想】四位同学作了如下猜想
(1)甲同学:NaCl
(2)乙同学:NaCl和HCl
(3)丙同学:NaCl和NaOH
(4)丁同学:NaCl、HCl、NaOH
【小组讨论】兴趣小组的同学讨论后发现不用做实验就可断定丁同学的猜想一定不正确,理由是氢氧化钠能与盐酸发生中和反应;
【查阅资料】NaCl溶液显中性,Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)等物质;
【实验验证】
| 实验操作 | 实验现象 | 实验结论 | |
| 乙同学实验 | 取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中 | 铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色 | 猜想(2)成立 |
| 丙同学实验 | 取中和反应后的溶液少许于试管中,向试管中添加几滴无色酚酞试液 | 溶液变红色 | 猜想(3)成立 |
| A. | 金刚石和石墨 | B. | CO和CO2 | C. | 冰和干冰 | D. | 液氧和氧气 |
| A. | 用红磷燃烧测定空气中氧气的含量时,用足量的红磷 | |
| B. | 做铁丝在氧气中燃烧实验前,在集气瓶内铺一层细沙 | |
| C. | 排水法收集气体,当导管口刚有气泡冒出时立即收集 | |
| D. | 过滤操作中,过滤时漏斗末端管口应紧靠烧杯内壁,漏斗液面应低于滤纸边缘 |
| A. | 图书馆图书着火,用液态二氧化碳灭火器灭火 | |
| B. | 厨房天然气、液化气泄漏时,立即打开排气扇 | |
| C. | 在加油站里加油时,用空闲时间接、打手机 | |
| D. | 电器设备着火时,先用干粉灭火器灭火再切断电源 |