题目内容
14.某兴趣小组在做完碳还原氧化铜实验后,进行了如图所示的探究.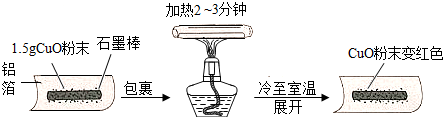
【猜想】把氧化铜还原成铜的物质:猜想Ⅰ:石墨棒; 猜想Ⅱ:铝箔.
【实验】小刘同学用天平称量 1.5g 氧化铜粉末,直接用铝箔纸包裹.按上述操作步骤实验,
黑色粉末不变色,那么猜想Ⅱ不成立.
【结论】石墨棒能使氧化铜还原成铜,该反应的化学方程式为2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
【改进】小胡同学把石墨棒换成“碳粉”,称取同样质量的氧化铜粉末,将二者均匀混合,也用
铝箔纸包裹,重复上述操作,实验效果更好,其原因是反应物接触面积越大,反应越充分.
【拓展】结合上述原因,小毛同学把“碳粉”换成“铝粉”,重复小胡同学的实验,实验也获得
成功,说明铝粉在高温时能还原氧化铜,该反应方程式为3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
【反思】小陈同学认为在某些实验中,固体药品的颗粒并不是越细越好,请帮她举一实例说明:
实验室制取二氧化碳时,不用粉末状大理石或石灰石.
分析 【猜想】
把氧化铜还原成铜的物质可能是石墨棒,也可能是铝箔,也可能是石墨棒和铝箔;
【实验】
根据实验结论可以判断实验现象,根据实验现象可以判断实验结论;
【结论】
高温条件下,氧化铜能和碳反应生成铜和二氧化碳;
【改进】
反应物接触越充分,反应速率越快;
【拓展】
高温条件下,铝和氧化铜反应生成铜和氧化铝;
【反思】
反应物颗粒越小,反应物接触越充分,反应速率越快.
解答 解:【猜想】
把氧化铜还原成铜的物质:猜想Ⅰ:石墨棒; 猜想Ⅱ:铝箔.
故填:铝箔.
【实验】
小刘同学用天平称量 1.5g 氧化铜粉末,直接用铝箔纸包裹.按上述操作步骤实验,黑色粉末不变色,那么猜想Ⅱ不成立.
故填:不变色.
【结论】
石墨棒能使氧化铜还原成铜,该反应的化学方程式为:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
故填:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
【改进】
重复上述操作,实验效果更好,其原因是反应物接触面积越大,反应越充分.
故填:反应物接触面积越大,反应越充分.
【拓展】
铝粉在高温时能还原氧化铜,该反应方程式为:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
故填:3CuO+2Al$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
【反思】
在某些实验中,固体药品的颗粒并不是越细越好,例如实验室制取二氧化碳时,不用粉末状大理石或石灰石,以防反应速率太快而不利于实验操作.
故填:实验室制取二氧化碳时,不用粉末状大理石或石灰石.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | 矿泉水 | B. | 自来水 | C. | 浮有冰的水 | D. | 新鲜的空气 |
| A. | HCl 和 Ca(OH)2 | B. | Na2CO3和 H2SO4 | C. | Ca(OH)2和 Na2CO3 | D. | KCl 和 CuSO4 |
| 物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
| 沸点 (℃) | -88.6 | -42.2 | -0.5 | 36.1 | 69.2 |
| A. | 乙烷、丙烷和丁烷 | B. | 乙烷、丙烷 | C. | 只有乙烷 | D. | 戊烷和己烷 |

 如图是甲、乙、丙三种固体物质的溶解度曲线,依据如图回答下列问题:
如图是甲、乙、丙三种固体物质的溶解度曲线,依据如图回答下列问题: 某化学兴趣小组的同学把两根光亮的细铁丝分别盘成螺旋状,进行如下实验:
某化学兴趣小组的同学把两根光亮的细铁丝分别盘成螺旋状,进行如下实验: