题目内容
15. 以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)
以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl.(已知NH4HCO3在40℃受热易分解)回答下列问题:
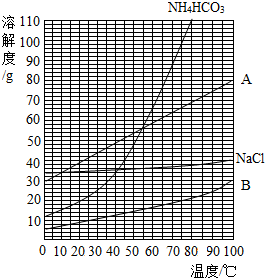
(1)该反应中的甲种物质溶解度曲线如图所示:
①35℃时,比较A、B溶解度的大小;A>B.(填“<”或“>”).
②图中表示NaHCO3溶解度曲线的是B.(填“A”或“B”).
(2)为探究NaHCO3析出的最佳条件,完成了如图几组实验:
| 实验序号 | 反应温度/℃ | 反应时间/min | NaHCO3产率/% |
| a | 30 | 60 | 86.8 |
| b | 30 | 120 | X |
| c | 35 | 60 | 89.4 |
| d | 35 | 120 | 92.5 |
| e | 40 | 60 | 85.3 |
| f | 40 | 120 | 85.6 |
②表格中X的数值可能为C.
A、85.8 B、86.8 C、92.1 D、93.1
③在相同反应时间,40℃时NaHCO3的产率比35℃时低的原因是在40℃时NH4HCO3受热容易分解,导致反应物减少.
分析 (1)①根据35℃时,A、B溶解度的位置关系,进行分析解答.
②根据题意,制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl,碳酸氢钠容易析出结晶形成沉淀,进行分析解答.
(2)①实验c、d的反应温度相同,而反应时间不同,进行分析解答.
②由实验a、c、e可得:当反应时间相同,反应温度上升的过程中,产率是先上升再下降,进行分析解答.
③由题意,NH4HCO3在40℃受热易分解,进行分析解答.
解答 解:(1)①观察图中 35℃时物质A的溶解度曲线在物质B的上方,35℃时,A的溶解度大于B的溶解度.
②由题意可知,碳酸氢钠容易析出结晶形成沉淀,即在同温度下碳酸氢钠的溶解度应该比碳酸氢铵小,由图象可知,B为碳酸氢钠.
(2)①实验c、d的反应温度相同,而反应时间不同,因此是探究反应时间对产物产率的影响.
②由实验a、c、e可得:当反应时间相同,反应温度上升的过程中,产率是先上升再下降(下降是因为碳酸氢铵在 40℃时易分解).因此实验 b、d、f 产率也应符合这一规律,因此X应大于86.8而小于92.5,C符合要求.
③由题意可得,在40℃时NH4HCO3受热容易分解,导致反应物减少.
故答案为:(1)①>;②B;(2)①探究反应时间对产物产率的影响;②C;③在40℃时NH4HCO3受热容易分解,导致反应物减少.
点评 本题难度不大,理解饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理、掌握溶解度曲线的含义是正确解答本题的关键.

练习册系列答案
相关题目
5.课外小组的同学上网查阅有关金属资料时,看到镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物.于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如图探究.

探究一:产生的无色气体是什么物质?探究实验如表所示.
探究二:白色不溶物N是什么物质?
[查阅资料]
(1)碱石灰是固体氢氧化钠和氧化钙的混合物.
(2)MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
[猜想与假设]
(1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ
①白色固体N,加入足量的稀盐酸,观察到固体N全部溶解,产生无色气泡,则白色固体N一定含有碳酸镁.(填名称)
②称取干燥、纯净的白色不溶物N22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入如图所示装置A和B中.实验后装置A增重1.8g,则白色固体中还含有氢氧化镁(填名称).

探究一:产生的无色气体是什么物质?探究实验如表所示.
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物N | / |
| 实验Ⅱ | 将实M气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现 | 气体M是H2,燃烧的化学方程式为 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
[查阅资料]
(1)碱石灰是固体氢氧化钠和氧化钙的混合物.
(2)MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
[猜想与假设]
(1)N可能为Mg(OH)2
(2)N可能为MgCO3
(3)N可能是Mg(OH)2和MgCO3的混合物.
实验Ⅲ
①白色固体N,加入足量的稀盐酸,观察到固体N全部溶解,产生无色气泡,则白色固体N一定含有碳酸镁.(填名称)
②称取干燥、纯净的白色不溶物N22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入如图所示装置A和B中.实验后装置A增重1.8g,则白色固体中还含有氢氧化镁(填名称).
3.下列有关水的说法正确的是( )
| A. | 水资源可以循环利用,没必要担心淡水资源不足 | |
| B. | 蒸馏水中加入肥皂水,振荡后有较多泡沫产生 | |
| C. | 矿泉水是纯净物 | |
| D. | 硬水通过活性炭吸附后可变为软水 |
10.健康的生活离不开化学,下列说法正确的是( )
| A. | 钙是人体中的微量元素 | |
| B. | 油脂是重要的营养物质,可大量摄入油脂 | |
| C. | 鸡蛋含有丰富的蛋白质 | |
| D. | 淀粉酶属于糖类,可用于为人体提供能量 |
20.下列实验现象的描述中,正确的是( )
| A. | 铁丝在氧气中燃烧,火星四射,生成黑色固体 | |
| B. | 硫在氧气中燃烧,发出淡蓝色火焰 | |
| C. | 红磷在空气中燃烧产生大量的白雾 | |
| D. | 木炭在氧气中燃烧,生成有刺激性气味的气体 |
7.2015年3月9日,太阳能飞机“阳光动力2号”开始环球飞行,并在名古屋和夏威夷之间创下了118小时不间断飞行的记录,下列有关能源和环保的说法错误的是( )
| A. | “阳光动力2号”所用太阳能是绿色环保新能源 | |
| B. | 煤、石油、天然气等化石燃料是不可再生能源 | |
| C. | 煤完全燃烧后就不会对环境造成污染 | |
| D. | 可燃冰具有能量高、燃烧值大等优点,其主要成分是CH4 |
4.下列说法错误的是( )
| A. | 在潮湿的空气中铁易生锈 | |
| B. | 生活中通过煮沸可以降低水的硬度 | |
| C. | 碳酸氢钠俗称苏打 | |
| D. | 控制二氧化碳的排放可以减缓温室效应 |
5.某化学学习小组的同学对一瓶久置的氢氧化钠的化学成分产生了兴趣,他们根据自己已学的知识进行如下探究,请你共同参与并填空:
[猜想假设]
猜想一:只有氢氧化钠
猜想二:是氢氧化钠和碳酸钠的混合物
猜想三:只有碳酸钠.
[查阅资料]
(1)BaCl2溶液显中性
(2)Na2CO3溶液与BaCl2溶液能反应产生白色沉淀
[实验探究]
[实验结论]
该氢氧化钠样品已部分变质,其化学成分是NaOH与Na2CO3的混合物,引起NaOH变质的化学方程式为CO2+2NaOH=Na2CO3+H2O.
[反思交流]
(1)实验室应密封保存氢氧化钠;
(2)某同学认为用CaCl2溶液代替BaCl2溶液也可以得到同样的结论,另一位同学认为不可以,理由是:CaCl2溶液和NaOH溶液相混合也会出现浑浊.因为Ca(OH)2是微溶于水的物质.
[猜想假设]
猜想一:只有氢氧化钠
猜想二:是氢氧化钠和碳酸钠的混合物
猜想三:只有碳酸钠.
[查阅资料]
(1)BaCl2溶液显中性
(2)Na2CO3溶液与BaCl2溶液能反应产生白色沉淀
[实验探究]
| 实验步骤 | 实验现象 | 实验结论 |
| (1)用小试管取少量固体样品加水完全溶解,再滴加过量BaCl2溶液 | 产生白色沉淀 | 猜想一不正确 |
| (2)取(1)中的少量上层清液于试管中,滴加酚酞溶液 | 溶液变红 | 猜想二正确、猜想三不正确 |
该氢氧化钠样品已部分变质,其化学成分是NaOH与Na2CO3的混合物,引起NaOH变质的化学方程式为CO2+2NaOH=Na2CO3+H2O.
[反思交流]
(1)实验室应密封保存氢氧化钠;
(2)某同学认为用CaCl2溶液代替BaCl2溶液也可以得到同样的结论,另一位同学认为不可以,理由是:CaCl2溶液和NaOH溶液相混合也会出现浑浊.因为Ca(OH)2是微溶于水的物质.
